N是重要的非金属元素,尿素、羟胺、硝酸、亚硝酸钠均为重要的含氮化合物。
(1)尿素[CO(NH2)2]是人类利用无机物合成的第一种有机物。
①尿素中元素原子半径最大的原子结构示意图为 ;
②尿素在土壤中的脲酶作用下会水解生成碳酸铵或碳酸氢铵,若与碱性肥料混合施用,会造成氮元素损失,请用离子方程式解释其原因 ;
③已知:20oC时,H2CO3:Ka1=4.2×10ˉ7、Ka2=5.6×10ˉ11;NH3·H2O:Kb=1.7×10ˉ5,碳酸氢铵溶液中HCO3ˉ、NH4+、OHˉ、H+四种离子浓度由大到小的顺序为
(2)羟胺(NH2OH)可看做是氨分子内的1个氢原子被羟基取代的物质,常用作还原剂。
①利用羟胺的还原性,可以除去含Fe2+中的Fe3+,氧化产物是一种性质稳定、无污染的气体,写出反应的离子方程式 ;
②制备NH2OH·HCl(盐酸羟胺)的一种工艺流程如下图所示: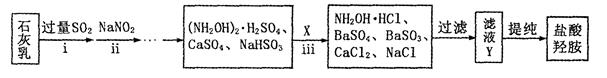
ⅰ步骤中,发生反应的化学方程式为 ;
ⅱ步骤中使用的NaNO2外观酷似食盐,误食会中毒。可用电解法将工业废水中少量的NO2ˉ转化为N2以降低其危害。写出NO2ˉ在酸性条件下转化为氮气的电极反应式为 ________ 。
ⅲ步骤中,X为 (填化学式);若要使滤液Y中SO42ˉ、SO32ˉ浓度均小于1×10ˉ5mol/L,溶液中Ba2+浓度应不小于 [已知KSP(BaSO3)= 5.0×10ˉ10;KSP(BaSO4)= 1.1×10ˉ10]
③用惰性电极电解硝酸溶液可制备NH2OH。写出其阳极反应式 ;
请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:

(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是(填“增大”、“减小”或“不变”,下同),ΔH的变化是。请写出NO2和CO反应的热化学方程式:。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为。
(3)如表所示是部分化学键的键能参数:
| 化学键 |
P—P |
P—O |
O===O |
P===O |
| 键能/kJ·mol-1 |
a |
b |
c |
x |
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=kJ·mol-1(用含a、b、c、d的代表数式表示)。
二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
Ⅰ.工业制备二甲醚的生产流程如下: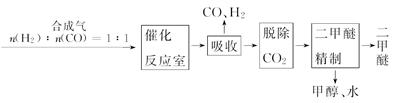
催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g) 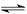 CH3OH(g)ΔH=-90.7 kJ/mol ①
CH3OH(g)ΔH=-90.7 kJ/mol ①
2CH3OH(g) 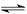 CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CO(g)+H2O(g) 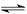 CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
(1)甲烷氧化可制得合成气,反应如下:CH4(g)+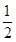 O2(g)
O2(g) 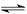 CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是反应(填“自发”或“非自发”)。
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是反应(填“自发”或“非自发”)。
(2)催化反应室中总反应3CO(g)+3H2(g) 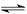 CH3OCH3(g)+CO2(g)的ΔH=。830℃时反应③的K=1.0,则在催化反应室中反应③的K1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的ΔH=。830℃时反应③的K=1.0,则在催化反应室中反应③的K1.0(填“>”、“<”或“=”)。
(3)上述反应中,可以循环使用的物质有。
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。b电极是极。
反应aA(g)+bB(g) cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
回答问题:
(1)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是,其值是;
(2)由第一次平衡到第二次平衡,平衡移动的方向是,采取的措施是;
(3)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2T3(填“>”、“<”、“=”),判断的理由是。
如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的棒,乙装置中的棒。
②乙装置中阳极的电极反应式是:。
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:。
②甲装置中碳极的电极反应式是,乙装置碳极的电极反应属于(填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因:。
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=(可用分数表示)。能说明该反应达到化学平衡状态的是(填字母)。
a.容器内的密度保持不变
b.容器内压强保持不变
c.v正(N2)=2v逆(NH3)
d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)。