下列反应的离子方程式正确的是
| A.过氧化钠固体与水反应制氧气:2O22—+2H2O=4OH-+O2↑ |
| B.在100ml浓度为1 mol · L-1的Fe(NO3)3的溶液中通入足量SO22Fe3++SO2+2H2O==2Fe2++SO42-+4H+ |
| C.1mo·L-1的NaAlO2溶液和2.5mol· L-1的盐酸等体积混合:2AlO2-+ 5 H+=Al(OH)3 ↓+ Al3++ H2 O |
| D.向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO+H+=== HCO |
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 ==2CO2 +3H2O,电池示意如右图,
下列说法不正确的是()
| A.a极为电池的负极 |
| B.电池工作时电流由b极沿导线经灯泡再到a极 |
| C.电池正极的电极反应为:4H+ + O2 + 4e— = 2H2O |
| D.电池工作时,1mol乙醇被氧化时就有6mol电子转移 |
下图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是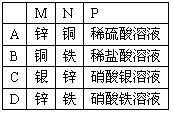

取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )
| A.b电极是阴极 | B.a电极与电源的正极相连 |
| C.电解过程中水是氧化剂 | D.b电极附近溶液的pH变小 |
右图为直流电源电解稀Na2SO4水溶液的装置,
通电后在石墨电极a和b附近分别滴加石蕊溶液,下列实验现象正确的是( )
| A.逸出气体的体积:a电极的小于b电极的 |
| B.a电极附近呈蓝色,b电极附近呈红色 |
| C.a电极附近呈红色,b电极附近呈蓝色 |
| D.电极逸出无味气体,另一电极逸出刺激性气味气体 |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,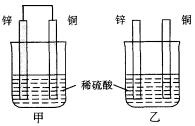
以下叙述正确的是()
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速度甲比乙慢 |