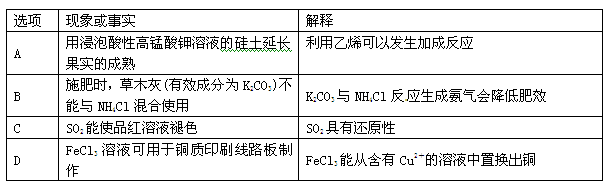
下列指定反应的离子方程式正确的是
| A.Fe2O3溶于HI溶液中:Fe2O3 + 6H+=2Fe3++ 3H2O |
| B.[Ag(NH3)2]OH的溶液中加入盐酸:Ag+ + Cl-= AgCl↓ |
| C.Na2S2O3溶液吸收Cl2:4Cl2 + S2O32-+5H2O= 10H+ + 2SO42-+ 8Cl- |
| D.(NH4)2Fe(SO4)2溶液中加入过量NaOH溶液:NH4++ Fe2++3OH-=Fe (OH)2↓+ NH3·H2O |
下列有关溶液组成的描述合理的是
| A.常温下在c(H+)=1×10-13mol/L的溶液中能大量存在Mg2+、Cu2+、SO42-、NO3 |
| B.使甲基橙试液变红的溶液中可能大量存在Na+、ClO‾、SO42‾、I‾ |
C.使PH试纸变蓝的溶液中可大量存在Na+、K+、AlO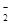 、CO 、CO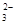 |
| D.常温下,在水电离产生的c(H+)×c(OH-)=1×10-24的溶液中可大量存在Fe2+、Cl-、NO3-、K+ |
下列试剂的保存方法正确的是
| A.氢氟酸保存在玻璃瓶中 ,烧碱溶液存放在带有玻璃塞的试剂瓶中 |
| B.水玻璃存放在滴瓶中,硝酸银溶液保存在无色广口瓶中。 |
| C.少量金属钠保存在煤油中,少量白磷保存在水中。 |
| D.液溴直接存放在棕色滴瓶中,浓硝酸保存在带橡胶塞的无色玻璃瓶中。 |
下列说法不正确的是
| A.铜片在稀硫酸和NaNO3混合溶液中可溶解 |
| B.常温常压下,46gNO2和N2O4混合气体共含有3mol原子 |
| C.光纤通讯中制造光纤的基本原料是SiO2 |
| D.光照氯水有气泡逸出该气体是Cl2 |
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
| A.78g 苯含有C=C双键的数目为3NA |
| B.室温下,1LpH=13的Ba(OH)2溶液中,溶液中的OH-离子数目为0.2NA |
| C.0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA |
| D.含2molH2SO4的浓硫酸与足量铜片在加热条件下反应,产生NA个SO2气体分子 |
化学与社会、生活密切相关。对下列现象或事实的解释正确的是