锰锌铁氧体(ZnaMnbFecO4,Fe元素为+3价,Zn、Mn元素化合价相同)是一种重要的磁性材料。测定铁氧体中ZnO的实验步骤如下:
(1)a、b、c的代数关系式为 。
(2)“除锰”时发生反应的离子方程式为 。
(3)配制溶液A用的玻璃仪器有 、烧杯、玻璃棒及胶头滴管。
(4)准确量取25.00 mL溶液A,二甲酚橙作指示剂,用0.01000mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Zn2+(反应原理为Zn2++H2Y2-=ZnY2-+2H+),至滴定终点时消耗EDTA 标准溶液20.00 mL。通过计算确定该铁氧体中ZnO的质量分数(写出计算过程)。
取一定量的Na2CO3和Na2SO4混合物溶液与过量盐酸反应,生成2.016 L CO2(标准状况),然后加入足量的Ba(OH)2溶液,得到沉淀的质量为2.33 g。试计算混合物中Na2CO3和Na2SO4的物质的量分别为多少。
已知在101 kPa时,CO的燃烧热为283 kJ·mol-1。相同条件下,若2 mol CH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,甲烷的燃烧热是多少?
(2)现有CO和CH4组成的混合气体共0.75 mol,完全燃烧生成二氧化碳气体和18 g液态水,放出热量为多少?
(3)120 ℃、101 kPa下,a mL由CO和CH4组成的混合气体在b mL O2中完全燃烧后,恢复到原温度和压强。①若混合气体与O2恰好完全反应,产生b mL CO2,则混合气体中CH4的体积分数为____________(保留2位小数)。
②若燃烧后气体体积缩小了a/4 mL,则a与b关系的数学表示式是__________________。
人民网曾报道,日本事业集团在太空建立巨大的集光装置,把太阳光变为激光用于分解海水制氢: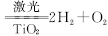 ,下列说法中不正确的是
,下列说法中不正确的是
| A.反应物H2O的总能量高于生成物H2和O2的总能量 |
| B.TiO2可以提高H2O的分解率 |
| C.反应为吸热反应 |
| D.使用氢气作燃料有利于控制温室效应 |
已知反应FeO(s)+CO(g) Fe(s)+CO2(g)的Kc=0.5(1 273 K)。若起始浓度c(CO)=0.05 mol·L-1,c(CO2)=0.01 mol·L-1,请回答:
Fe(s)+CO2(g)的Kc=0.5(1 273 K)。若起始浓度c(CO)=0.05 mol·L-1,c(CO2)=0.01 mol·L-1,请回答:
(1)判断化学反应进行的方向并计算反应物、生成物的平衡浓度。
(2)CO的转化率是多少?
(3)增加FeO的量,对平衡有无影响?
在101 kPa时,1 mol甲烷完全燃烧生成二氧化碳和液态水放出890.3 kJ的热量,甲烷的燃烧热为多少?1 000 L甲烷(标准状况下)燃烧后所产生的热量为多少?