(12分)【选做题】本题包括A、B两小题,请选定其中一小题,并作答。若多做,则按A小题评分。
A.[物质结构与性质]原子序数小于36的X、Y、Z、W四种元素,X基态原子的最外层电子数是其内层电子数的2倍,Y基态原子的2p原子轨道上有3个未成对电子,Z是地壳中含量最多的元素,W的原子序数为22。
(1)W基态原子的核外电子排布式为________。元素X、Y、Z的电负性由大到小的顺序为________。
(2)与XYZ-互为等电子体的一种分子、一种离子分别为________、________(填化学式)。
(3)二元弱酸H2X2Z4中X原子轨道的杂化类型是_______,1 molH2X2Z4分子中含有σ键的数目为_______。
(4)YH3极易溶于水的主要原因是________________。元素W的氧化物WO2可与氢氟酸发生非氧化还原反应,生成配合物HnWF6,该反应的化学方程式为________。
(5)Z、W与Ca形成晶体的晶胞如图所示,该晶体的化学式为________。
(9分)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等类型的化合物。
⑴写出氯离子的离子结构示意图 ▲ 。
⑵写出卤素互化物溴碘原子比1∶1的共价化合物(IBr)的电子式 ▲ ,其中溴元素的化合价为 ▲ 。
⑶氟化氢气体的沸点较高,这是因为氟化氢分子之间存在 ▲ 。
⑷①HClO4、②HClO、③H2SO4的酸性由强到弱的顺序为 ▲ (填序号)。
⑸用新制的氯水、NaBr溶液、四氯化碳作为试剂,验证氯气的活泼性强于溴单质。简述实验操作过程和实验现象 ▲ 。
⑴写出金属钾与水反应的离子方程式 ▲ ;
⑵写出苯发生硝化反应的化学方程式 ▲ ;
⑶将一根亮红色的铜丝放置于酒精灯外焰上加热,然后由外焰逐渐向内焰处移动,发现铜丝由亮红色转化为黑色,进入火焰的内焰后铜丝黑色又转化为亮红色。写出黑色转化为亮红色这一现象所发生反应的化学方程式 ▲ 。
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同主族元素。又知B、D两元素的原子核中质子数之和是A、C两元素的原子核中质子数之和的2倍。这四种元素的单质中常温下有两种是气体,其中一种气体易燃烧,另外两种为固体,其中一种是黄色晶体,质脆,易研成粉末。
⑴写出元素符号:A ▲ B ▲ C ▲ D ▲ 。
⑵写出两种均含A、B、C、D四种元素的化合物相互反应放出气体的化学方程式:
▲ 。
⑶用电子式表示化合物C2D形成过程 ▲ 。
⑷用A和B两元素的单质可以制成燃料电池,电池中装有浓KOH溶液。用多孔的惰性电极浸入浓KOH溶液中,两极均有特制的防止气体透过隔膜,在一极通入A的单质,另一极通入B的单质。写出通入B单质的一极电极反应式是: ▲ 。
(8分)在下列各组物质中,找出合适的序号填在对应的空格内:
①NO2和N2O4 ②12C和14C ③
④
⑤ ⑥甲烷与丙烷
⑥甲烷与丙烷
⑦乙醇(CH3CH2OH)和乙二醇(HO—CH2—CH2—OH)
注意:以上七组物质,不一定是每组物质都能找到对应填空
⑴互为同位素的是 ▲ ;⑵互为同分异构体的是 ▲ ;
⑶互为同系物的是 ▲ ;⑷同一种物质的是 ▲ 。
已知蓝铜矿的主要成分是2CuCO3·Cu(OH)2,受热易分解。铝土矿的主要成分是Al2O3、Fe2O3、SiO2。经过一定条件的转化二者均可转化为金属单质,根据下列框图转化回答问题: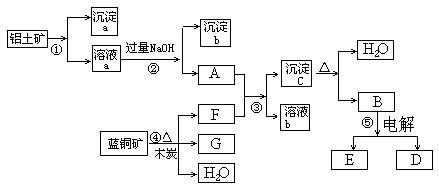
(1)写出①的离子方程式:______________________、_____________________。
(2)经过④、⑤步反应得到铜和金属铝,写出反应的化学方程式:
_____________________、______________________。
(3)若过量F与A反应,溶液b的成分是:______(写化学式)。