下列叙述中正确的是
| A.根据上图,若滴定前仰视读数,滴定终点时俯视读数,则测定的盐酸浓度偏高 |
| B.25℃时,难溶物XY和AB3的KSP分别为1.0×10-10和2.7×10-15,则饱和溶液中C(X+)一定大于C(A3+) |
| C.每个Fe(OH)3胶体粒子含一个氢氧化铁分子 |
| D.某溶液中存在K+、HCO-3、CO2-3、OH-、H+,其离子浓度大小顺序可能为c(K+)>c(HCO-3)>c(H+)>c(CO32-) |
一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2、和水的总质量为27.6 g,若其中水的质量是10.8 g ,则CO2的质量为
| A.1.4 g | B.15.4 g | C.4.4 g | D.12.4 g |
以下物质既能够使溴水褪色,又能够与钠反应放出氢气,但不能使pH试纸变色的是
| A.CH2=CH-COOH | B.CH2=CH-COOCH3 |
| C.CH3CH2OH | D.CH2=CH-CH2OH |
乙烯和乙醇的混合气体V L,完全燃烧生成CO2和H2O,消耗相同状态下的O2 3V L,则混合气体中乙烯和乙醇的体积比为
| A.1∶1 | B.2∶1 | C.1∶2 | D.任意比 |
将1-氯丙烷跟NaOH的醇溶液共热,生成的产物再跟溴水反应,得到一种有机物,它的同分异构体有(除它之外)
| A.2种 | B.3种 | C.4种 | D.5种 |
有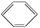 、CH3CH2OH、CH3CH2Br、NH4Cl溶液四种无色液体,只用一种试剂就能把它们鉴别开,这种试剂是
、CH3CH2OH、CH3CH2Br、NH4Cl溶液四种无色液体,只用一种试剂就能把它们鉴别开,这种试剂是
| A.溴水 | B.NaOH溶液 | C.Na2SO4溶液 | D.Br2的CCl4溶液 |