某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol若向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是
| A.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3- |
| B.若向该溶液中加入过量的稀硫酸,产生的气体在空气中能变成红棕色 |
| C.若向该溶液中加人过量的稀硫酸和KSCN溶液,溶液显血红色 |
| D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
下列图象不符合事实是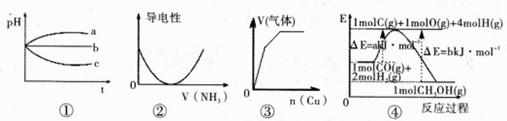
| A.图①:pH相同的H2S溶液、稀H2SO4溶液、H2SO3溶液露置于空气中一段时间后,溶液的pH随时间的变化情况 |
| B.图②:表示向乙酸溶液中通入NH3过程中溶液导电性的变化 |
| C.图③:将铜粉加入到一定量浓硝酸中产生的气体与加入铜量的变化情况 |
| D.图④知合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(g) △H= -(b-a)kJ·mol-1 |
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)=0时,c(H+)=1×10-2 mol/L |
| B.V(NaOH)<10 mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C.V(NaOH)=10mL时,c(H+)=1×10-7 mol/L |
| D.V(NaOH)>10 mL时,c(Na+)>c(HC2O4-)>c(C2O42-) |
室温下,向a mol/L氨水中逐滴加入盐酸,下列描述不正确的是
| A.pH减小 | B.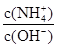 增大 增大 |
| C.水的电离程度先减小后增大 | D.Kb(NH3·H2O)不变 |
下列实验不能达到目的的是
| A.向25mL沸水中滴加5-6滴稀的FeCl3溶液制备氢氧化铁胶体 |
| B.只用少量水就可鉴别Na2CO3和NaHCO3固体 |
| C.用FeSO4、NaOH和盐酸等试剂在空气中可以制备较纯净的FeCl3溶液 |
| D.用NaOH溶液和盐酸可除去MgCl2溶液中混有的AlCl3 |
如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是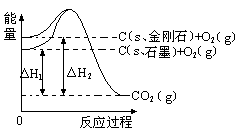
| A.石墨和金刚石的转化是物理变化 |
| B.C(s、石墨)==C(s、金刚石) △H=" +1.9" kJ•mol-1 |
| C.金刚石的稳定性强于石墨 |
| D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |