Al、Fe、Cu、S都是中学化学常见元素。
某混合物由Al2O3、Cu2O、Fe3O4组成,将该混合物进行如下处理: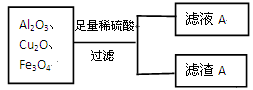
①滤渣A的化学成分为____________(填化学式),则上述过程中,含“铜”物质发生反应的离子方程式为Cu2O+2H+ Cu+Cu2++H2O、__________________________;
②滤液A中有无Fe3+?___________(填“有”或“无”),验证方法是_____________(所述验证方法需与前一空的结论一致)
③向滤液A中加入过量NaOH溶液时Al3+发生反应的离子方程式为______________________。
(1)CuFeS2中Fe的化合价为_______价,CuFeS2与氧气反应可得产物Cu2S、FeS和SO2,则该反应的氧化产物为_______________________(填化学式)。
(2)SO2的排放会造成大气污染,可设计如图所示装置用SO2生产硫酸。写出SO2的电极反应方程式:________,也可用NaOH溶液吸收SO2,所得NaHSO3溶液pH<7,则该溶液中存在离子的物质的量浓度由大到小的顺序是____________________。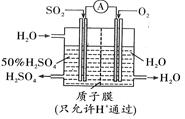
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·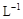 盐酸中,得溶液C;
盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出 l.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①产物中的单质B是__________________。
(2)②中所发生的各反应的化学方程式是________________________________,_________________________________________________________。
(3)③中所发生的各反应的离子方程式是________________________________,_________________________________________________________。
(4)NaClO是一种很强的氧化剂,请写出酸性环境中NaClO将Fe2+氧化的离子方程式_________________________________________________________。
(5)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为___________________,c(Fe2+)为____________________。
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核只有一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1。
请回答下列问题: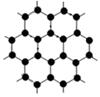
(1)这四种元素中电负性最大的是(填元素符号)、第一电离能最小的是(填元素符号) ;
(2)C所在的主族元素气态氢化物中,沸点最低的是(填化学式);
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图所示,其原子的杂化类型为;
(4)D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是(填选项序号);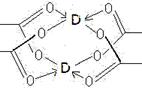
①极性键②非极性键③配位键④金属键
(5)某学生所做的有关D元素的实验流程如下图:
已知D的硫化物为黑色难溶性物质,请书写第⑤反应的离子方程式:。
锂和铍单质及化合物的性质具有特殊性。
I.石墨可以用作锂电池的负极材料,Li+嵌入石墨层间,形成LiC6嵌入式化合物,正极材料常用LixCoO2。
(1)电负性LiBe(填“>”或“<”)。
(2)Co元素基态原子核外价电子排布式为。
(3)在LiC6中,Li+与相邻石墨六元环的作用力类型为。
II.固体氯化铍结构如图: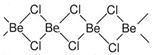
(4)铍原子杂化轨道类型为。
(5)氯化铍分子中含有化学键类型有(填序号)。
| A.极性键 | B.非极性键 | C.配位键 | D.离子键 |
(1)在标准状况下,气体A的密度为1.25g/L,气体B的相对分子质量为42,A和B的混合气体在相同状况下对H2的相对密度为16.8,则混合气体中A和B的体积比为。
(2)把500 mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子的物质的量浓度为。
写出下列反应的离子方程式:
①用稀硫酸清洗铁锈(Fe2O3)
②将锌粒加入到稀硫酸中
③NaHCO3溶液与盐酸混合
④向足量澄清石灰水中通入二氧化碳