NO2、O2和熔融KNO3,可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。下列说法不正确的是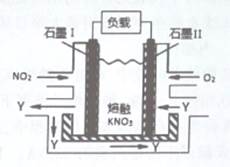
| A.NO2在石墨I附近发生氧化反应 |
| B.该电池放电时N03-向石墨I电极迁移 |
| C.石墨Ⅱ附近发生的反应:O2+4e-+2N205=4N03- |
| D.相同条件下,放电过程中消耗的NO2和O2的体积比为l:4 |
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1KHC2O4溶液中,下列关系正确的是
| A.c(K+)+ c(H+)= c(HC2O4-)+ c(OH-)+ c(C2O42-) |
| B.c(HC2O4-)+ c(C2O42-)=" 0.1" mol·L-1 |
| C.c(H2C2O4)>c(C2O42-) |
| D.c(K+)= c(H2C2O4)+ c(HC2O4-)+ c(C2O42-) |
常温下,下列有关叙述正确的是
| A.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| B.NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol/L |
| C.pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液中,c(NH4+)大小顺序①>②>③ |
| D.10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH=7,所得溶液体积V(总)≥20mL |
常温下,用 0.1000 mol·L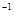 NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L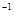
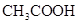 溶液所得滴定曲线如下图。下列说法正确的是
溶液所得滴定曲线如下图。下列说法正确的是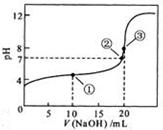
A.点①所示溶液中: |
B.点②所示溶液中: |
C.点③所示溶液中: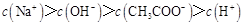 |
D.滴定过程中可能出现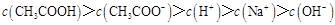 |
在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有
| A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I- |
| B.pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- |
| C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Al3+ |
| D.能与铝反应产生H2的溶液:K+、Ba2+、NO3-、Al3+ |
用食用白醋(醋酸浓度约1 mol•L-1)进行下列实验,能证明醋酸为弱电解质的是
| A.白醋中滴入石蕊试液呈红色 | B.白醋加入豆浆中有沉淀产生 |
| C.蛋壳浸泡在白醋中有气体放出 | D.pH试纸显示白醋的pH为2~3 |