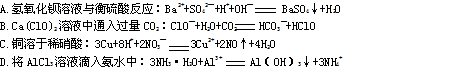用下列装置进行相应实验、能达到实验目的的是
| A.图1所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 |
| B.图2所示装置用于除去碳酸氢钠固体中的少量碳酸钠 |
| C.图3所示装置配制100 mL 0.1 mol-L-1的硫酸 |
| D.图4所示装置用于分离出溴苯 |
为测写某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100mL0.3mol·L—1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560mL;再加0.2mol·L—1NaOH溶液至沉淀质量恰在此时好不再变化,用去350mL NaOH溶液。则所取样品中铝的物质的量为
| A.0.005mol | B.0.01mol | C.0.025mol | D.0.03mol |
氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:
Na3N+H2O→NaOH+NH3 NaH+H2O→NaOH+H2
有关它们的叙述正确的是
| A.离子半径:N3—>Na+>H+ |
| B.与水反应都是氧化还原反应 |
| C.与盐酸反应都只生成一种盐 |
| D.两种化合物中的阴阳离子均具有相同的电子层结构 |
四种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z—离子的电子数之差为8。下列说法不正确的是
| A.与W想邻的同主族元素可制成重要的半导体材料 |
| B.元素原子半径从大到小的顺序是X、Y、Z |
| C.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4 |
| D.X的单质在W的最高价氧化物中的燃烧反应属于置换反应 |
在下列溶液中一定能大量共存的离子组是
| A.pH=2的溶液:Fe2+、NH4+、Cl—、NO3— |
B.能使pH试纸变深蓝色的溶液:Na+、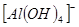 、S2—、CO32— 、S2—、CO32— |
| C.含有大量Fe3+的溶液:SCN—、I—、K+、Br— |
| D.澄清透明的无色溶液:ClO—、MnO4—、Al3+、SO42— |
下列离子方程式的书写不正确的是