【化学-选修3,物质结构与性质】X、Y、Z、W都是元素周期表中的前四周期元素,它们的核电荷数依次增大。X原子的最外层p轨道的电子为半充满结构,Y是地壳中含量最多的元素。Z元素形成的一种化合物常用作净水剂。W元素是第四周期元素中未成对电子数最多的元素,WCl3能与X、Y的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,1mol配合物与足量的AgNO3溶液反应能生成3molAgCl。请回答下列问题:
(1)XH3可作低温溶剂,它易液化的原因是 ,Y所在周期中第一电离能最大的主族元素是 。
(2)XY3-离子的立体构型是 ,其中心原子采取 杂化。
(3)W3+的核外电子排布式是 ,WCl3形成的六配位的配合物化学式为 。
(4)某种Z—Fe合金的晶胞如图所示,该合金的化学式为 。若晶胞的边长为a nm,则合金的密度为 g·cm-3。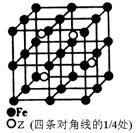
已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
②c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
③c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
④c(CH3COO-)>c(Na+)> c(OH-) > c(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是,上述四种离子浓度的大小顺序为(填编号)。
(2)若上述关系中③是正确的,则溶液中的溶质为。
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则混合前两溶液的物质的量浓度大小关系为c(NaOH)c(CH3COOH)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系是c(H+)c(OH-)。
向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:
(1)经5min后达平衡,此时容器内压强为起始时的1.2倍,则用Y表示的速率为____________mol(L·min)。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一时间内测得的反应速率分别为:甲:ν(X)=3.5mol(L·min);乙:ν(Y)=2mol(L·min);丙:ν(Z)=4.5mol(L·min);丁:ν(X)=0.075mol(L·s)。若其他条件相同,温度不同,温度由高到低的顺序是(填序号)________________。
(3)若向达到(1)的平衡体系中充入氮气,则平衡 向___(填“左”“右”或“不”,下同)移动;若将达到(1)的平衡体系中移走部分混合气体,则平衡向___移动。
向___(填“左”“右”或“不”,下同)移动;若将达到(1)的平衡体系中移走部分混合气体,则平衡向___移动。
(4)若在相同条件下向达到(1)所述平衡体系中再充入0.5molX气体,则平衡后X的转化率与(1)的平衡中X的转化率相比___
| A.无法确定 | B.前者一定大于后者 |
| C.前者一定等于后者 | D.前者一定小于后者 |
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达平衡时仍与(1)的平衡等效,则a、b、c应满足的关系为____________。
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达平衡时仍与(1)的平衡等效,则起始时维持化学反应向逆反应方向进行,则c的取值范围应为______________。
(6分)(1)P4(白磷,s)+5O2(g)=P4O10(s)ΔH=-2983.2kJ/mol
(2)P(红磷,s)+5/4O2(g)=1/4 P4O10(s)ΔH=-738.5kJ/mol
则白磷转化为红磷的热化学方程式为___________________。相同状况下,能量较低的是______;红磷的稳定性比白磷____
(10分)A~H是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知B、D是生活中常见的金属单质,G是气体单质,C的焰色反应呈黄色。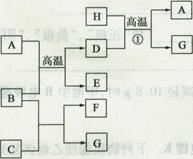

请回答下列问题:
(1)元素B在周期表中的位置是,C的电子式为,H的结构式为。
(2)反应①的化学方程式为。
(3)A与盐酸反应的离子方程式为。
(4)F溶液显(填“酸性”、“中性”或“碱性”),原因是(用离子方程式表示)。
(10分)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中
溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。
请回答下列问题:
(1)甲池为(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为。
(2)丙池中F电极为(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应
方程式为。
(3)当乙池中C极质量减轻10.8 g时,甲 池中B电极理论上消耗O2的体积为mL(标准状况)。
池中B电极理论上消耗O2的体积为mL(标准状况)。
(4)一段时间后,断开电键K。下列物质能使乙池恢复到反应前浓度的是(填选项字母)。
| A.Cu | B.CuO | C.Cu(OH)2 | D.Cu2(0H)2CO3 |