氯化硫酰(SO2Cl2)是一种无色液体,遇水剧烈水解,其熔点为-54.1 ℃,沸点为69.1 ℃,可用作氯化剂及锂电池正极活性物质。氯化硫酰可用下列反应制取:
SO2(g)+Cl2(g) SO2Cl2(l) △H=-97.3 kJ/mol。
SO2Cl2(l) △H=-97.3 kJ/mol。
(1)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是(用字母编号填写): 。
a.缩小容器体积 b.使用催化剂 c.提高SO2浓度 d.提高温度
(2)300 ℃时,在体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO2 7.616 g,则300 ℃时合成SO2Cl2反应的平衡常数的为: 。
(3)某同学设计了下图所示装置制取氯化硫酰:
①有关该装置的说法正确的是(用字母编号填写): 。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和NaHSO3溶液
b.B处反应管内五球中玻璃棉上的活性炭起催化作用
c.B处反应管的冷却水应从m接口通入
d.装置C处吸滤瓶应放在冰水中冷却
e.D处U形管中盛放的可能是碱石灰
②从化学平衡的角度分析,反应管通冷却水的目的是: 。
③氯磺酸(ClSO3H)受热分解也可制得氯化硫酰,并得到另外一种物质,该反应的化学方程式为______,分离产物的方法是: 。
(4)下图为GET公司开发的Li-SO2Cl2军用电池的示意图。已知该电池的总反应为:2Li+SO2Cl2=2LiCl+SO2↑,则该电池工作时的正极反应为:_______________________。
下图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH2K2CO3+6H2O
(1)请回答:
甲电池是装置,B(石墨)电极的名称是。
(2)写出下列电极反应式:
通入CH3OH 的电极的电极反应式是:,
B(石墨)电极的电极反应式为:。
(3)乙池中反应的化学方程式为。
(4)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上转移电子mol。
常温下,取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合后溶液的pH=8的原因是____________________________(用离子方程式表示)。
(2)混合后的溶液中由水电离出的c(OH-)____0.1 mol/L NaOH溶液中由水电离出的c(OH-) (填“>”、“<”或“=”)。
(3)已知NH4A溶液为中性,又知将HA溶液加到NaHCO3溶液中有气体放出,试推断NH4HCO3溶液的pH________7(填“>”、“<”或“=”)。
(4)有相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3; | B.NH4A; | C.(NH4)2SO4; | D.NH4Cl,按pH由大到小的顺序排列_______(填序号)。 |
在80℃时,将0.40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应N2O4(g) 2NO2(g)△H=" +57" kJ·mol-1,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g)△H=" +57" kJ·mol-1,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4)/mol |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2)/mol |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算a =,此温度时该反应的平衡常数K=;
(2)改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有(填序号)。
A.增大N2O4的起始浓度 B.升高温度
C.使用高效催化剂 D.向混合气体中通入稀有气体
根据条件推测下列有机物名称,其中A、B为不饱和烃,C为高分子化合物。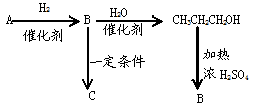
(1)写出各物质结构简式AB
(2)写出下列转化反应方程式及反应类型
B→C,
CH3CH2 CH2OH→B的方程式,
A和溴水(足量)的化学方程式,
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为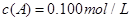 、
、 及
及 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_______________;③_______________;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;
(3)该反应的 Q_____0,判断其理由是________________;
(4)该反应进行到4.0min时的平均反应速度率:
实验②: =____________________;
=____________________;