【化学——选修2 化学与技术】选考高炉炼铁是钢铁生产中的重要环节。这种方法是由古代竖炉炼铁发展、改进而成的。尽管世界各国研究发展了很多新的炼铁法,但由于高炉炼铁技术经济指标良好,工艺简单,生产量大,劳动生产率高,能耗低,这种方法生产的铁仍占世界铁总产量的95%以上。
(1)高炉炼铁的原料有铁矿、焦炭和石灰石,其中起熔剂作用的是 ,目的是除去铁矿石中的脉石,其产物密度比铁 ,所以在铁水的 (填“上部”或“下部”)形成炉渣而与铁水分离。
(2)焦炭在高炉炼铁中起着举足轻重的作用,下列不属于焦炭作用的是 。
| A.作为燃料,为炼铁中的化学反应提供能量 |
| B.作为还原剂与二氧化碳反应产生还原氧化铁的一氧化碳 |
| C.对高炉中的物料起到支撑和疏散的作用 |
| D.除去铁矿石中的杂质 |
(3)高炉炼铁的污染非常严重,目前我国部分大城市中的钢铁厂借着搬迁的机会也在进行着工艺改进。高炉炼铁导致的环境污染有 。
(4)写出以赤铁矿为原料进行高炉炼铁时与碳元素有关的氧化还原反应化学方程式: 。
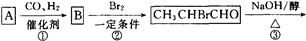
CYP73A1炔抑制剂的合成路线如下: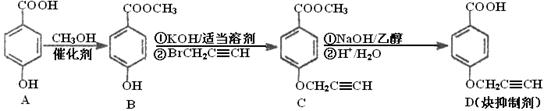
(1)化合物A核磁共振氢谱有____________种蜂。
(2)化合物C中含氧官能团有_______________、______________(填名称)。
(3)鉴别化合物B和C最适宜的试剂是____________________。
(4)写出A—B的化学方程式_____________________________。
(5)B的同分异构体很多,符合下列条件的异构体有______________种。
①苯的衍生物②含有羧基和羟基③分子中无甲基
(6)试以苯酚、氯乙酸钠(ClCH2COONa)、正丁醇为原料(无机试剂任用),结合题中有关信息,请补充完整的合成路线流程图。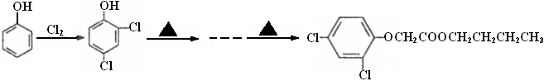
(12分) 氮化硅硬度大、熔点高、不溶于酸(氢氟酸除外),是一种重要的结构陶瓷材料。一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺主要流程如下: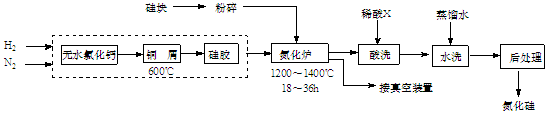
(1)净化N2和H2时,铜屑的作用是:;硅胶的作用是。
(2)在氮化炉中3SiO2(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度:;体系中要通入适量的氢气是为了。
(3)X可能是(选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(4)用硅粉作硅源、叠氮化钠(NaN3)作氮源,直接燃烧生成氮化硅(发生置换反应),该反应的化学方程式为:。
化合物A是来自石油的一种基本化工原料,用A和水煤气为原料经下列途径合成化合物D(分子式为C3H6O3)。
已知: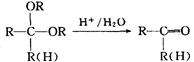
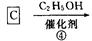
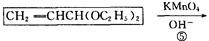

请回答下列问题;
⑴、写出有关物质的结构简式:A:;B:;C:;D:。
⑵、指出反应⑤的反应类型。
⑶、写出反应③的化学方程式。
⑷、反应④的目的是。
合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g) △H =-181.6kJ·mol-1。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g) △H =-181.6kJ·mol-1。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
⑴比较此时正、逆反应速率的大小:v正v逆(填“>”、“<”或“=”)。
⑵若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH) =mol·(L·min)-1。
⑶生产过程中,合成气要进行循环,其目的是。
化合物A、B、C、D、E分别由H+、Na+、Al3+、Cu2+四种阳离子和CO32-、Br-、SiO32-、SO42-四种阴离子组成。已知①A、B、C三种溶液pH<7,D、E溶液pH>7②A、C的阴离子相同,D、E的阳离子相同③用石墨电极电解A的溶液,阳极有无色气体产生,阴极有红色物质生成④C溶液与D溶液反应能生成一种白色沉淀和一种气体,且此沉淀可溶于B的溶液,此气体通入E的溶液中可产生另一种白色沉淀。
请根据以上事实填空:
⑴写出B、C、E的化学式:B___________、C___________、E____________。
⑵D溶液的pH>7,原因是:(结合离子方程式说明)__________________________________。
⑶写出C溶液与D溶液发生反应的离子方程式:_______________________。
⑷若用石墨电极电解400mL 1.0 mo1·L—1 A的溶液,当阳极有2.24 L气体(标准状况)产生时,溶液的pH=_______________(设溶液的体积不变)。