(17分)碳及其化合物与人类生产、生活密切相关。(1)在化工生产过程中,少量CO的存在会引起催化剂中毒,为了防止催化剂中毒,常用SO2将CO氧化,SO2被还原为S。
已知:C(s)+1/2O2(g)=CO(g)△H1=-126.4kJ·mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ·mol-1
S(s)+O2(g)=SO2(g) △H3=-296.8kJ·mol-1
则SO2氧化CO的热化学反应方程式为____________。
(2)CO可用于合成甲醇,化学方程式为CO(g)+2H2(g) CH3OH(g) △H=-90.8KJ·mol-1。
CH3OH(g) △H=-90.8KJ·mol-1。
①在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是______℃;该温度下上述反应的化学平衡常数为_______。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为___________;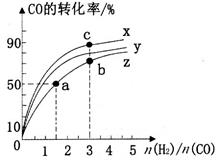
②在密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状。当改变某一反应条件后,下列变化能说明平衡一定向正反应方向移动的是______(填序号)。
| A.正反应速率瞬间增大,后逐渐减小 |
| B.混合气体的密度增大 |
| C.化学平衡常数K值增大 |
| D.反应物的体积百分含量增大 |
(3)一种新型CO燃料电池工作原理如图所示。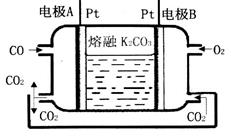
①负极电极反应式为_______________________;
②电极A处产生的CO2有部分参与循环利用,其利用率为____________。
(14分)某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32ˉ、SO42ˉ、SiO32ˉ、NO中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。
请回答下列问题:
(1)由强酸性条件即可判断溶液X中一定不存在的离子有 ;
(2)溶液X中,关于NO3-的判断一定正确的是;
A一定有B.一定没有C.可能有
(3)产生气体A的离子方程式为;
(4)转化⑥发生反应的现象为;
(5)转化④中产生H的离子方程式为;
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为;
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液①NaOH溶液 ②KSCN溶液 ③石蕊试剂 ④pH试纸 ⑤KMnO4溶液 ⑥氯水和KSCN的混合溶液中的一种,根据现象即可判断,该试剂最好是。
甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 |
平衡常数 |
温度(℃) |
|
| 500 |
800 |
||
①2H2(g)+CO(g)  CH3OH(g) CH3OH(g) |
K1 |
2.5 |
0.15 |
②H2(g)+CO2(g)  H2O (g)+CO(g) H2O (g)+CO(g) |
K2 |
1.0 |
2.50 |
③3H2(g)+ CO2(g)  CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) |
K3 |
(1)反应②是(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A)K(B)(填“>”、“<”或“=”)。
(3)判断反应③△H0; △S0(填“>”“=”或“<”)据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示)。在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正)v(逆)(填“>”“=”或“<”)
(4)甲醇燃料电池通常采用铂电极,其工作原理如图所示,负极的电极反应为:。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将0.2 mol/L的醋酸与0.1 mol/LBa(OH)2溶液等体积混合,则混合溶液中离子浓度由大到小的顺序为 。
近年来,我国对储氢纳米碳管的研究获得了重大进展,电弧法合成的纳米碳管常伴有大量物质——碳纳米颗粒。这种碳纳米颗粒可用氧化法提纯。其反应的化学方程式为:
C +K2Cr2O7+H2SO4(稀)="=" CO2+K2SO4+Cr2(SO4)3+
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂是,氧化产物是。
(3)H2SO4在上述反应中表现出来的性质是。
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(4)上述反应中若产生11.2 L(标准状况下)的气体物质,则转移的电子数目为。
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温度(℃) |
360 |
440 |
520 |
| K值 |
0.036 |
0.010 |
0.0038 |
(1)①写出工业合成氨的化学方程式。
②由上表数据可知该反应为放热反应,理由是。
③理论上,为了增大平衡时H2的转化率,可采取的措施是。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g) + H2O (g) CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的 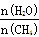 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: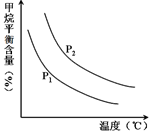
①图中,两条曲线表示压强的关系是:P1P2(填“>”、“=”或“<”)。
②该反应为反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g) + H2O(g) CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为,该反应平衡常数的表达式为。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2) =" 1" : 1 : 1 : 1
亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程: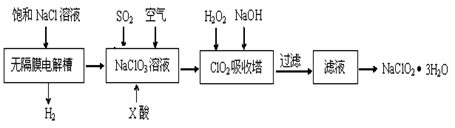
已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用。
②ClO2气体在中性和碱性溶液中不能稳定存在。
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式。
(2)反应生成ClO2气体需要X酸酸化,X酸可以为。
A.盐酸B.稀硫酸C.HI溶液
(3)吸收塔内的温度不能过高的原因为。
(4)ClO2被S2-还原为ClO2-、Cl-转化率与pH关系如图。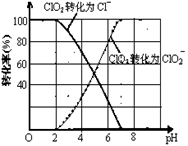
写出pH≤2时ClO2与S2-反应的离子方程式:。