25℃时,下列有关电解质溶液中微粒的关系不正确的是
| A.pH=4的氯化铵溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B.pH=3的氯化铵溶液中: c(OH-)=1.0×10-11mol·L-1 |
| C.将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大 |
| D.向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+) = c(SO42-) >c(NH4+) >c(H+) > c(OH-) |
NA表示阿佛加德罗常数,下列说法正确的是()
| A.0.1molFe与0.1molCl2充分反应转移电子数为0.2NA |
| B.16g甲基正离子(13CH3+)所含中子数为9NA |
| C.关于反应:C2H2(g)+2.5O2(g)= 2CO2(g)+H2O(1)+1300kJ,若CO2中有4NA 对共用电子对生成,则放出热量为1300kJ |
| D.0.lmol/L Fe2(SO4)3溶液200mL中阴离子和阳离子总数为0.1NA |
对由X、Y元素形成的化合物X2Y2的叙述正确的是()
| A.若是离子化合物,则阳阴离子个数比肯定不等于1:1 |
| B.若由分子构成且有Y-Y键,则肯定是非极性分子 |
| C.若溶于水时有X-Y键的断裂,则肯定是强电解质 |
| D.若X、Y原子间的共价键键能大,则熔、沸点肯定高 |
下列氮原子结构的表述中,对电子运动状态描述正确且能表明同一电子层电子能量有差异的是()C原子结构
A.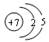 |
B.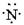 |
C.1s22s22p3 |
D. |
日本核电站附近检测到放射性原子131I。关于131I 原子和127I原子的叙述错误的是()
| A.它们互称为同位素 | B.它们的化学性质几乎完全相同 |
| C.它们相差4个质子 | D.它们的电子数相同 |
氯的含氧酸根离子有ClO-、ClO2-、ClO3-、ClO4-等,关于它们的说法正确的是
| A.ClO-中Cl-显+1价 | B.ClO2-的空间构型为直线形 |
| C.ClO3-的空间构型为三角锥形 | D.ClO4-是SO42-的等电子体 |