(1)据报道以硼氢化合物NaBH4(H的化合价为-1价) 和 H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。写出该电池放电时负极的电极反应式: 。
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。
已知:N2H4(l) + O2(g) = N2(g)+ 2H2O(l) △H =" –" 534 kJ·mol—1
H2O2(l)= H2O(l) + 1/2O2(g) △H =" –" 98.6 kJ·mol—1
写出常温下,N2H4(l) 与H2O2(l)反应生成N2和H2O的热化学方程式: 。
(3)O3可由臭氧发生器(原理如图所示)电解稀硫酸制得。
①图中阴极为 (填“A”或“B”)。
②若C处通入O 2,则A极的电极反应式为: 。
(4)向一密闭容器中充入一定量的一氧化碳和水蒸气,发生反应:
CO(g)+H2O(g) CO2(g)+H2(g),下列情况下能判断该反应一定达到平衡状态的是_______(选填编号)。
CO2(g)+H2(g),下列情况下能判断该反应一定达到平衡状态的是_______(选填编号)。
| A.v正(H2O) = v逆(H2) |
| B.容器中气体的压强不再发生改变 |
| C.H2O的体积分数不再改变 |
| D.容器中CO2和H2的物质的量之比不再发生改变 |
E.容器中气体的密度不再发生改变
(5)温度T1时,在一体积为2L的密闭容积中,加入0.4molCO2和0.4mol的H2,反应中c(H2O)的变化情况如图所示,T1时反应CO(g)+H2O(g) CO2(g)+H2(g)第4分钟达到平衡。在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在右图中画出第5分钟到9分钟c(H2O)浓度变化的曲线。
CO2(g)+H2(g)第4分钟达到平衡。在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在右图中画出第5分钟到9分钟c(H2O)浓度变化的曲线。
(1)在一个白色点滴板的二个孔穴中分别加入火柴梗、少量CuSO4·5H2O。分别滴入几滴浓硫酸,观察现象。回答下列问题:
浓硫酸滴到火柴梗上,火柴梗变________(填实验现象),说明浓硫酸具有________性。
浓硫酸滴入CuSO4·5H2O中,胆矾(填实验现象),说明浓硫酸具有_________性。
(2)为探究Fe3+能转化为Fe2+,实验室提供下列试剂:铁粉、0.1mol·L-1 FeCl3溶液、0.1mol·L-1 FeCl2溶液、KSCN溶液、新制氯水。请你就实验操作、实验现象、结论完成以下填空:
取少量溶液于试管中,加入足量,充分振荡后静置,滴加1至2滴,无明显变化,说明Fe3+已转化为Fe2+。
以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空: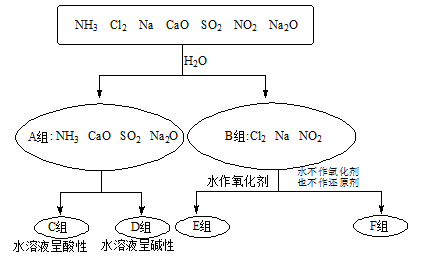
(1)上述第一级分类标准(分成A、B组的依据)是。
(2)F组中物质除了Cl2外还有(填化学式)
(3)D组中的氨水呈弱碱性,用电离方程式表示呈弱碱性的原因:。
(4)由Al3+制备Al(OH)3,最好不选择D组中的NaOH溶液,说明理由:。
(14分)某小组同学欲探究NH3与O2反应的反应过程,按下列装置进行实验。
(1)A、B装置中可选药品:浓氨水、H2O2、CaO、CaCO3、MnO2、浓盐酸、蒸馏水。
①则A装置中发生反应的化学方程式为_____________________________;B装置中锥形瓶中盛放的药品是______。
②E装置中氨气被催化氧化生成一氧化氮时的化学方程式为_______________。
③F装置中可以看到有红棕色气体和白烟生成,红棕色气体是__________(填化学式,下同),白烟的成分____________。
(2)另一小组的同学撤掉A、C装置,只用剩余装置来完成此实验,B装置中分液漏斗盛放的是浓氨水,那么B装置中的锥形瓶中盛放的固体药品是_____________。
(3)工业上制取的浓硝酸往往呈黄色,该小组成员设计实验探究硝酸呈黄色的原因,提出如下假设,请你完成假设二。
假设一:可能含有Fe3+;假设二:可能含有_____;假设三:可能含有上述两种微粒。检验是否含有Fe3+的方法是:取少量样品于试管中,加水稀释,__________________________(补充操作步骤、现象和结论)。
(4)工业上用氨、氧气和水为原料制取硝酸铵,如果用17吨氨气,最多可制取_______吨硝酸铵 (硝酸铵的相对分子质量为80)。
(12分)根据下图所示的关系,确定A、B、C、D、E、F的化学式,并写有关方程式。
(1)已知A为单质,则A为(填化学式,下同),E为。
(2)D→E的化学方程式为___________________________________。
(3)取少量C溶于水,加入酸化的硝酸银溶液,有白色沉淀生成,则A→C的化学方程式为_____________________________。
(4)某学习小组设计如下装置进行相关实验:
①打开活塞b,向溶液B中逐滴加入少量溴水,关闭活塞b;
②打开活塞a,向容器中滴入足量的亚硫酸。
按要求回答下列问题:
①滴入溴水时,溶液的颜色变为棕黄色,该反应的离子方程式为________。
②滴入亚硫酸时,溶液由棕黄色变为浅绿色,该反应的离子方程式为______。
③由此可知,B中的阳离子、Br-、H2SO3还原性由强到弱的顺序是___________(B中的阳离子用离子符号表示)。
(7分)下图是用废铜料(铁、铜混合物)来生产胆矾(CuSO4·5H2O)的过程,请根据图示回答下列问题。
(1)试剂X是___________(填名称)。
(2)途径Ⅱ的化学方程式为____________________________________。
(3)有关途径Ⅰ和途径Ⅱ的说法正确是___________(填编号)
a.途径Ⅰ的操作步骤比途径Ⅱ多,因此采取途径Ⅱ更合理
b.途径Ⅰ相比途径Ⅱ节省原料,且不产生污染
c.相同质量的单质A完全反应生成硫酸铜的量与途径无关
d.每生成1mol B,消耗1mol氧化剂,转移2mol电子
(4)称取25g胆矾,加热冷却后称量固体的质量减少了7.2g,则所得固体的化学式为___________。