某二次电池充、放电的化学方程式为:2K2S2+KI3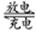 K2S4+3KI。与其它设备连接的电路如图示。当闭合开关K时,X附近溶液先变红。则下列说法正确的是
K2S4+3KI。与其它设备连接的电路如图示。当闭合开关K时,X附近溶液先变红。则下列说法正确的是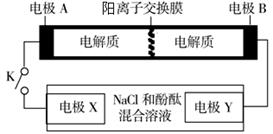
| A.K+从右到左通过离子交换膜 |
| B.A的电极反应式为:3I--2e-= I3- |
| C.当有0.1 mol K+通过离子交换膜,X电极上产生气体1.12 L(标准状况下) |
| D.电池充电时,B电极要与外电源的正极相连,电极上发生还原反应 |
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图。下列叙述中正确的是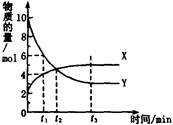
A反应的化学方程式为5Y X
X
B t1时,Y的浓度是X浓度的1.5倍
C t2时,正、逆反应速率相等
D t3时,逆反应速率大于正反应速率
下列关于电离度的叙述正确的是
A电离度越小,表示弱电解质越弱
B对同一弱电解质一般是浓度越小,温度越高,电离度越大
C向醋酸溶液中滴加浓盐酸,则两种酸的电离度均变小
D弱电解质的电离度随溶液的稀释而增大,在不断稀释过程中,溶液的导电性不断增强.
在-50℃时,液氨可发生如下电离2NH3 NH4++NH2-,两种离子的平衡浓度均为1×10-15mol/L,下列有关叙述不正确的是
NH4++NH2-,两种离子的平衡浓度均为1×10-15mol/L,下列有关叙述不正确的是
A升高温度(仍然为液态),液氨的电离程度变大
B在液氨中放入NaNH2,则液氨的离子积数值将增大
C在此温度下,液氨的离子积数值为1×10-30
D在液氨中放入NH4Cl,则液氨中的c(NH4+)将大于c(NH2-)
下列表述中正确的是
A任何能使熵值增大的过程都能自发进行
B△H<0,△S>0的化学反应一定能自发进行
C已知热化学方程式2SO2(g)+O2(g)  2SO3(g);△H=-QkJ·mol-1(Q>0),
2SO3(g);△H=-QkJ·mol-1(Q>0),
则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量
D稀溶液中1mol NaOH分别和1mol CH3COOH、1molHNO3反应,两者放出的热量一样多
下列各组中,离子能大量共存的是
A NH4+、Na+、SO42-、OH- B NH4+、H+、Cl-、CO32-
C K+、NH4+、NO3-、Cl- D Fe2+、NH4+、NO3-、H+