一定质量的下列各组物质的混合物,不管两者以何种质量比混合,充分燃烧后所生成的H2O的质量都相等,该混合物可能是
| A.乙醇和乙烯 | B.甲醛和葡萄糖 |
| C.乙烯和乙酸乙酯 | D.丙烷和乙醛 |
常温下,取pH=2的 HA溶液与HB溶液各1 mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示。下列叙述正确的是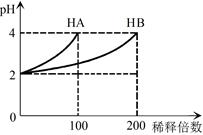
A.HB的电离方程式为HB=H++B-
B.稀释前,c(HB) > c(HA)=0.01 mol·L-1
C.NaA的水溶液中,离子浓度大小为c(Na+)>c(A-)>c(OH-)>c(H+)
D.NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)
W、X、Y、Z四种短周期元素。已知X原子的核外电子数和Ne原子相差1,在同周期中X原子半径最大,W、Y、Z在周期表中的相对位置如图,Z的非金属性在同周期元素中最强。下列说法不正确的是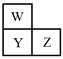
| A.简单离子半径:Y>X |
| B.最高价氧化物对应水化物的酸性:Z>Y |
| C.W与X形成的化合物属于离子化合物 |
| D.W、X、Z只能形成一种化合物 |
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则A不可能是
A.金属单质B.非金属单质C.两性氧化物D.碱
密闭容器中,发生反应:CO(g) + 2H2(g) CH3OH(g)△H<0,下列说法正确的是
CH3OH(g)△H<0,下列说法正确的是
| A.一定温度下,压缩容器体积,则正反应速率加快,逆反应速率减慢 |
| B.若v生成(CH3OH)=v消耗(CO),则该反应达到平衡状态 |
C.升高温度,重新达到平衡时, 增大 增大 |
| D.使用催化剂,反应的平衡常数增大 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,2.24 L NH3分子中共价键数目为0.3 NA |
| B.1 L 1 mol·L-1H2O2溶液中氧原子数目为2 NA |
| C.25℃时,pH=7的纯水中OH-数目为1×10-7 NA |
| D.1 L 0.1 mol·L-1NH4Cl溶液中NH4+数目为0.1 NA |