一定条件下,在体积一定的密闭容器中加入1 mol N2和3 mol H2发生反应:N2 + 3H2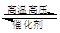 2NH3(正反应是放热反应)。下列有关说法正确的是
2NH3(正反应是放热反应)。下列有关说法正确的是
| A.达到化学反应限度时,可生成2mol NH3 |
| B.向容器中再加入N2,可以加快反应速率 |
| C.降低温度可以加快反应速率 |
| D.1mol N2和3mol H2的总能量低于2mol NH3的总能量 |
下列说法正确的是
| A.苯中含有杂质苯酚,可用浓溴水来除杂 |
B.1mo1 在一定条件下与足量NaOH溶液反应,最多消耗3 mol NaOH 在一定条件下与足量NaOH溶液反应,最多消耗3 mol NaOH |
C.按系统命名法,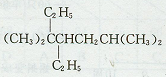 的名称为3,3,6一三甲基-4-乙基庚烷 的名称为3,3,6一三甲基-4-乙基庚烷 |
D.已知C-C键可以绕键轴自由旋转,结构简式为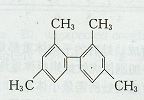 的分子中至少有11个碳原子处于同一平面上 的分子中至少有11个碳原子处于同一平面上 |
化学在生产和日常生活中有着重要的应用。下列说法正确的是
| A.棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O,对环境不会有影响 |
| B.侯氏制碱法是将NH3和CO2先后通入饱和氯化钠溶液中直接得到碳酸钠晶体 |
| C.我国自行研制的“神十”航天服是由新型“连续纤维增韧”材料做成的,其主要成分是由碳化硅陶瓷和碳纤维复合而蛾的,它是一种新型无机非金属材料 |
| D.PM2.5是指大气中直径≤2.5×10-6m的颗粒物(气溶胶),可通过加水吸收后再利用过滤的方法分离PM2.5微粒和可溶性吸附物 |
11.2升由甲烷、乙烷、甲醛组成的混合气体,完全燃烧后生成15.68升CO2(气体体积均在同温同压下测定),混合气体中乙烷的体积百分含量为
| A.20% | B.40% | C.60% | D.80% |
下列各项事实能够说明有机物分子内基团间的相互影响会导致物质化学性质不同的是①苯酚与溴水常温可以反应,而苯与溴水不能反应;②甲苯能使酸性高锰酸钾溶液褪色,而乙烷不能使酸性高锰酸钾溶液褪色;③苯酚与氢氧化钠溶液可以反应,而乙醇不能与氢氧化钠溶液发生反应;④甲苯与浓硝酸(浓硫酸/△)作用可得到2,4,6三硝基甲苯,而苯与浓硝酸(浓硫酸/△)作用得到硝基苯。
| A.只有①③ | B.只有②④ | C.只有①③④ | D.①②③④ |
阿斯匹林的结构简式为: ,则1摩尔阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为
,则1摩尔阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为
| A.1摩 | B.2摩 | C.3摩 | D.4摩 |