下列各组元素的性质递变情况错误的是
A.Li、C、O原子最外层电子数依次增加
B.P、S、Cl元素最高正化合价依次升高
C.N、O、F原子半径依次增大
D.Li、Na、K的金属性依次增强
对含微量I-的某样品进行I-化学定量测定,有以下两种途径,最后均是以淀粉作指示剂,用Na2S2O3标准溶液滴定以求得I-的浓度。下列分析正确的是
已知:5I-+IO3-+6H+=3H2O+3I2 I-+3Br2(过量)+3H2O=6H++6Br-+IO3-
方法一I-(样品) IO3-
IO3-
 I2
I2 I-
I-
方法二I-(样品) I2
I2 I-
I-
| A.方法二对样品所做处理操作简便,用作微量的测定更准确 |
| B.当待测液由无色变为蓝色时即达到滴定终点 |
| C.方法一与方法二测量出的样品浓度比为6:l |
| D.假设各步骤操作均得当,方法一所消耗Na2S2O3标准溶液的体积是方法二的6倍 |
有编号为A、B、C、D的四瓶无色液体,仅知道是1%酚酞、0.1mol·L-1NaOH溶液、0.1mol·L-1盐酸和0.1mol·L-1NaCl溶液。化学老师现要求甲、乙、丙、丁四位学生对它们进行鉴别,规定每人只需鉴别两瓶溶液,如果两瓶溶液鉴别都正确,得满分,如果只有一瓶鉴别正确,则算及格。以下是四位学生的鉴别结果:
| A |
A为0.1mol·L -1盐酸 |
D为0.lmol·L-1NaCl溶液 |
老师评价:四位学生都及格,但是没有一个得满分 |
| B |
A为0.1mol·L -1NaOH溶液 |
C为0.1mol·L-1盐酸 |
|
| C |
A为1%酚酞 |
B为0.1mol·L-1盐酸 |
|
| D |
D为0.1mol·L-1盐酸 |
B为0.1mol·L-1 NaOH溶液 |
下列结论正确的是
A.A为1%酚酞 B.B为0.1mol·L-1NaCl溶液
C.C为0.1mol·L-1NaOH溶液D.D为0.1mol·L-1盐酸
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是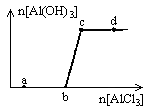
| A.a点对应的溶液中:Na+、Fe3+、SO42-、HCO3- |
| B.b点对应的溶液中:Na+、S2-、SO42-、Cl- |
| C.c点对应的溶液中:Ag+、Ca2+、NO3-、F- |
| D.d点对应的溶液中:K+、NH4+、I-、CO32- |
下列实验与物质微粒大小无直接关系的是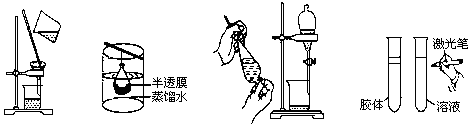
| A.过滤 | B.渗析 | C.萃取 | D.丁达尔效应 |
过氧化钠与CO2作用,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2↑。当0.2molNa2O2与足量CO2完全反应后,下表对生成物Na2CO3和O2的描述中正确的是
| Na2CO3的质量 |
关于O2的描述 |
|
| A |
21.2g |
O2的摩尔质量是36g·mol-1 |
| B |
21.6g |
生成标准状况下O2的体积为2.24L |
| C |
21.6g |
O2的摩尔质量是34g·mol-1 |
| D |
22.4 g |
生成标准状况下O2的体积为2.24mL |