下列叙述正确的是
| A.铅蓄电池放电过程中,正极质量增加,负极质量减小 |
| B.将0.1 mol·L-1的NH3·H2O溶液加水稀释, c(NH4+)/c(NH3·H2O)比值减小 |
| C.NaHCO3溶于水,溶液中存在电离平衡。 |
| D.CaCO3(s)===CaO(s)+CO2(g),ΔH>0,该反应在任意温度下都能自发进行。 |
有关晶体的说法不正确的是
| A.都有自范性 | B.都是无色透明的 | C.有各向异性 | D.有固定熔点 |
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是
A.CO2的电子式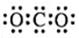 |
B.Cl-的结构示意图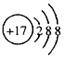 |
| C.乙烯的结构简式 C2H4 | D.质量数为37的氯原子 17 37Cl |
下列关于价电子构型为3s23p4的粒子描述正确的是
| A.它的元素符号为O 1s 2s 2p 3s 3p |
B.其电子排布图为: |
| C.它可与H2生成液态化合物 |
| D.它的核外电子排布式为1s22s22p63s23p4 |
在下列的电子结构中,第一电离能最小的原子可能是(下列n值相同)
| A.ns2np3 | B.ns2np5 | C.ns1 | D.ns2np6 |
下列事实与氢键有关的是
| A.水加热到很高的温度都难以分解 |
| B.水结冰成体积膨胀,密度减少 |
| C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高 |
| D.HF、HCI、HBr、HI的热稳定性依次减弱 |