某课外学习小组在学习了Na2O2与CO2的反应后,认为Na2O2与SO2应该也可以反应。他们设计了下图装置(夹持装置已略去,装置的气密性良好)进行实验,探究SO2与Na2O2反应的产物,请按要求回答下列问题。
Ⅰ﹒写出装置A中发生反应的化学方程式:___________________________
Ⅱ﹒装置D的作用:除了可以防止空气中的CO2、水蒸气等进入C中与Na2O2反应,还可以_____________
Ⅲ﹒在通入足量的SO2与Na2O2充分反应后,他们对C中固体产物提出如下假设:
假设1:只有Na2SO3;
假设2:_________;
假设3:既有Na2SO3,又有Na2SO4。
(1)若假设1成立,写出SO2与Na2O2反应的化学方程式:________________
(2)为进一步确定C中反应后固体产物的成分(Na2O2已反应完全),甲同学设计了如下实验:
甲同学由此得出结论:产物是Na2SO4,该方案是否合理______(填“是”或“否”),理由是_____________
(3)乙同学设计了如下实验验证假设3成立,请帮助他完成下表。
| 实验步骤 |
现象 |
| ①取少量C中固体产物于试管中,加入适量的蒸馏水溶解。 |
固体全部溶解 |
| ②向上试管中加入过量的_____________,将产生的气体通入少量酸性KMnO4溶液中。 |
KMnO4溶液__________ |
| ③向步骤②反应后的试管中,加入适量的BaCl2溶液。 |
产生白色沉淀 |
步骤②中将产生的气体通入少量酸性KMnO4溶液中,发生反应的离子方程式为:__________
为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5 min后发现装有AgNO3溶液的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应。
(1)装置I中①的化学方程式为____________________,___________________。
(2)①中长导管的作用是________________________________________________。
(3)烧瓶中生成的红褐色油状液滴的成分是__________________________,要想得到纯净的产物,可用____________试剂洗涤。洗涤后分离产品应使用的仪器是_______________。
(4)甲做实验时,乙观察到烧瓶中液体沸腾并有红棕色气体从导管中逸出,提出必须先除去红棕色气体,才能验证锥形瓶中的产物,原因是_____________________________。
(5)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是___________________________________
b中的试剂是_________________________________
比较两套装置,装置Ⅱ的主要优点是:(答出两点即可)
①____________________________________________
②____________________________________________
某活动小组进行实验室制取硝基苯和溴苯的实验,
(1)写出制取硝基苯的化学方程式______________________
写出制取溴苯的化学方程式______________________
(2)两个实验中除苯外,还需选用哪些药品_______________(可以多选)
| A.溴水 |
| B.液溴 |
| C.浓硝酸 |
| D.稀硝酸 |
E.浓硫酸
F.稀硫酸
G.Fe粉
H.氯化铁
(3)用如图所示装置制取硝基苯时,长玻璃导管的作用是_________。
(4)纯净的溴苯是无色,密度比水大,不溶于水的液体,因溶有溴而呈褐色,可加入_____________溶液洗涤除去其中的溴,写出该溶液除去溴的反应的化学方程式________________________________。
实验室制取硝基苯常用下图装置:
(1)苯的硝化反应是在浓H2SO4和浓HNO3的混合酸中进行的,混酸的添加顺序是先加后加 。
(2)请写出该反应的方程式_______________________________。
(3)被水浴加热的试管口部都要带一长导管,其作用是_____________________________
(4)苯的化学性质是易取代,那么除了苯的硝化反应外,你还能写出其他的取代反应方程式吗?请写出 .
(2012年海南卷)实验室制备1,2-二溴乙烷的反应原理如下:
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示: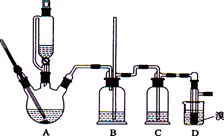
有关数据列表如下:
| 乙醇 |
1,2-二溴乙烷 |
乙醚 |
|
| 状态 |
色液体 |
无色液体 |
无色液体 |
| 密度/g·cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
一l30 |
9 |
-1l6 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应b.加快反应速度
c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体 (填正确选项前的字母)
a.水b.浓硫酸
c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a.水b.氢氧化钠溶液c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用 的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
某兴趣小组同学在实验室用加热l-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如下装置,其中夹持仪器、加热仪器及冷却水管没有画出。
请根据实验步骤,回答下列问题: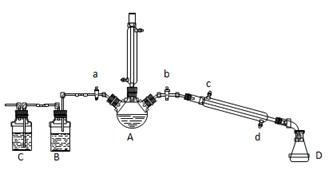
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。冷凝回流的主要目的是 。
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等。
①熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。B、C中应盛放的试剂分别是 。
②有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH2CH2CH3”, 来确定副产物中存在丁醚。请你对该同学的观点进行评价: 。
(3)为了进一步分离、提纯1-溴丁烷,该兴趣小组同学查得相关有机物的有关数据如下:
| 物质 |
熔点/℃ |
沸点/℃ |
| 1-丁醇 |
-89.5 |
117.3 |
| 1-溴丁烷 |
-112.4 |
101.6 |
| 丁醚 |
-95.3 |
142.4 |
| 1-丁烯 |
-185.3 |
-6.5 |
请你补充下列实验步骤,直到分离出1-溴丁烷。
①待烧瓶冷却后,拔去竖直的冷凝管;
② ;③ ;
④ ;⑤ ,收集所得馏分。
(4)若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g 1-溴丁烷,则1-溴丁烷的产率是 。