下列各溶液中,相关微粒物质的量浓度关系不正确的是
| A.0.1 mol·L-1NH3·H2O溶液中:c(NH4+)<c(OH-) |
| B.0.1 mol·L-1NH4C1溶液中:c(NH4+)+c(H+)==c(Cl-)+c(OH-) |
| C.0.1 mol·L-1Na2CO3溶液中:c((HCO3-)+c(CO3-)+c(H2CO3)="0.1" mol·L-1 |
| D.浓度均为0.1 mol·L-1的NH4Cl、CH3COONH4,NH4HSO4溶液,c(NH4+)大小顺序: |
CH3COONH4>NH4Cl>NH4HSO4
已知酸式盐NaHB在水溶液中存在下列反应:①NaHB==Na++HB-②HB- H++B2-③HB-+H2O
H++B2-③HB-+H2O H2B十OH-,且溶液中c(H+)>c(OH-),下列说法中一定正确的是
H2B十OH-,且溶液中c(H+)>c(OH-),下列说法中一定正确的是
| A.NaHB为强电解质 | B.H2B为强酸 |
| C.H2B为弱电解质 | D.HB-的电离程度小于HB-的水解程度 |
为了使带Na2S溶液中c(Na+)/c(S2-)的比值变小,可加入的物质是
| A.适量的盐酸 | B.适量的NaOH溶液 |
| C.适量的FeCl2溶液 | D.适量的Na2S固体 |
下列叙述正确的是
| A.pH=3的酸溶液稀释l00倍后pH=5 |
| B.相同温度下,pH=3的溶液和pH=5的溶液相比,前者氢离子浓度是后者的100倍 |
| C.相同温度相同浓度的钾盐溶液中,酸式盐的pH一定小于正盐的pH |
| D.碳酸钠溶液在室温时的pH一定大于60℃时的pH |
已知25OC时,电离常数Ka(HF)=3.6 10-4 mol
10-4 mol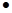 L-1,溶度积常数Ksp(CaF2)=1.46×10-10mol3
L-1,溶度积常数Ksp(CaF2)=1.46×10-10mol3 L-3。现向1L0.2 mol
L-3。现向1L0.2 mol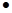 L-1HF溶液中加入1L0.2 mol
L-1HF溶液中加入1L0.2 mol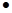 L-1CaCl2溶液,
L-1CaCl2溶液,
则下列说法中,正确的是
A.25oC时,0.1 mol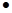 L-1HF溶液中pH=1 L-1HF溶液中pH=1 |
B.Ksp(CaF2)随温度和浓度的变化而变化 |
C.该体系中Ksp(CaF2)= |
D.该体系中有CaF2沉淀产生 |