元素的性质呈现周期性变化的根本原因是
| A.核电荷数逐渐增大 | B.元素的相对原子质量逐渐增大 |
| C.核外电子排布呈现周期性变化 | D.元素化合价呈现周期性变化 |
下列叙述正确的是( )
| A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a=b+1 |
| B.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的c(NH4+) = c(Cl-) |
| C.25℃ 0.5×10-3 mol/L硫酸的pH=3.0,升高温度溶液pH增大 |
| D.100℃时,KW=10-12,若pH=1的盐酸与pH=11 NaOH溶液混合后,溶液的pH=6,则盐酸与NaOH溶液体积比为1∶1 |
水的电离平衡曲线如图所示,下列说法不正确的是 ( )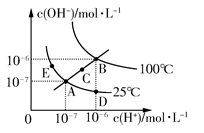
| A.图中五点KW间的关系:B>C>A=D=E |
| B.若从A点到D点,可采用在水中加入少量酸的方法 |
| C.若从A点到C点,可采用温度不变时在水中加入适量NH4Cl固体的方法 |
| D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性 |
向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述错误的是 ( )
| A.反应后溶液中c(Na+)=2c(SO42—) |
| B.a/2mol>沉淀的物质的量>0 |
| C.沉淀的质量=49a g |
| D.溶液中n(SO42—)=a/2 mol |
某温度下,CO2饱和溶液的浓度是0.03mol/L,其中1/3的CO2转变为H2CO3,而H2CO3仅有0.1%发生如下电离:H2CO3 H++HCO3—,则溶液的pH约为( )
H++HCO3—,则溶液的pH约为( )
| A.3 | B.4 | C.5 | D.6 |
已知相同条件下,HClO的电离常数小于H2CO3的一级电离常数(Ka)。为了提高氯水中HClO的浓度,可加入( )
| A.NaCl(s) | B.CaCO3(s) | C.H2O | D.NaOH(s) |