普通干电池的电极分别为碳棒和锌筒,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2,ZnCl2吸收NH3),电极反应可简化为:Zn-2e-=Zn2+,2NH4++2e-= 2NH3+H2。根据以上所述判断下列结论不正确的是
| A.工作时Zn为负极,发生还原反应 |
| B.工作时电流由碳极经外电路流向Zn极 |
| C.输出电流时碳棒上发生还原反应 |
| D.长时间使用后内装糊状物可能流出,腐蚀用电器 |
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断,正确的是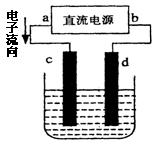
| A.a为负极、b为正极 |
| B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 |
| D.电解过程中,氯离子浓度不变 |
从手册上查得:H-H、Cl-Cl和 H-Cl的键能分别为436、243和431 kJ·mol-1,请用此数据估计,下列热化学方程式正确的是
A. H2(g)+Cl2(g)=2HCl(g);△H="-183" kJ·mol-1
B.H2(g)+Cl2(g)=2HCl(g);△H=+183kJ·mol-1
C. H2(g)+Cl2(g)=2HCl(g);△H=-91.5kJ·mol-1
D. H2(g)+Cl2(g)=2HCl(g);△H=+91.5k J·mol-1
J·mol-1
根据下表信息,判断以下叙述正确的是部分短周期元素的原子半径及主要化合价
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
| 主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
| A.氢化物的沸点为H2T<H2R | B.单质与稀盐酸反应的速率为L<Q |
| C.M与T形成的化合物具有两性 | D.L2+与R2-的核外电子数相等 |
根据下图提供的信息,下列所得结论正确的是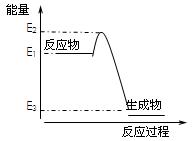
| A.该反应是吸热反应 |
| B.该反应的生成物比反应物稳定 |
| C.该反应一定可以设计成为原电池 |
| D.该反应向外界放出的热量为E2-E3 |