镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH
溶液,其充、放电过程按下式进行:Cd + 2NiOOH + 2H2O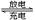 Cd(OH)2 + 2Ni(OH)2,
Cd(OH)2 + 2Ni(OH)2,
有关该电池的说法正确的是
| A.充电时阳极反应:Ni(OH)2-e—+ OH—="=" NiOOH + H2O |
| B.充电过程中镉元素被氧化 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH—向正极移动 |
含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
| A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl- |
| B.x=0.6a,2Br-+ Cl2=Br2+2Cl- |
| C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- |
| D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- |
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O,2Fe3++H2O2=2Fe2++O2↑+2H+下列说法正确的是
| A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 |
| B.在H2O2分解过程中,溶液的pH逐渐下降 |
| C.在H2O2分解过程中, Fe2+和Fe3+的总量发生变化 |
| D.H2O2生产过程要严格避免混入Fe2+ |
用NA表示阿伏加德罗常数的值,则下列叙述正确的是
| A.标准状况下,2.24LSO3含有的分子数等于0.1NA |
| B.常温下,1.0L 1.0 mol·L-1NaAlO2溶液中含有的氧原子数为2NA |
| C.7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| D.0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.2 NA |
2011年3月18日至19日,受“吃碘盐能防止核辐射”等谣言的影响,我国部分地区出现抢购食盐现象。已知碘盐的主要成分是KIO3和NaCl,KIO3与NaHSO3发生反应:
2KIO3+6NaHSO3=2KI+3Na2SO4+3H2SO4,下列说法中不正确的是
| A.KIO3中I的化合价是+5 | B.KIO3和NaCl都是强电解质 |
| C.KIO3作氧化剂发生还原反应 | D.23Na37Cl中质子数和中子数之比是8:7 |
下列说法正确的是
| A.摩尔质量就等于物质的式量 |
| B.摩尔质量就是物质式量的6.02×1023倍 |
| C.HNO3的摩尔质量是63g |
| D.硫酸和磷酸的摩尔质量相等 |