下列变化中,通过一步反应就可以直接完成的是
| A.Al2O3→ Al(OH)3 | B.CaCO3→ Ca(OH)2 |
| C.CH3CH2OH →CH3CHO | D.CO→ Na2CO3 |
某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断:该溶液中肯定不存在的离子组是()
| A.Al3+、Mg2+、I-、SO32- | B.Mg2+、Na+、CO32-、I- |
| C.Al3+、Na+、SO32-、I- | D.Al3+、CO32-、Br-、SO32- |
美国科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料,每填充一次燃料,大约可连续24小时输出50W的电力。一极通人空气,另一极通人丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-,下列对该燃料电池的说法不正确的是()
| A.电路中每流过5mol电子,肯定有5.6 L丙烷被完全氧化 |
| B.该电池的总反应是:C3H8+5O2→3CO2+4H2O |
| C.在熔融电解质中,O2-由正极移向负极 |
| D.通丙烷的电极为电池负极,发生的电极反应为:C3H8-20e-+10O2-=3CO2 +4H2O |
不活泼金属不能与非氧化性酸发生自发的置换反应,但某学生喜欢探究欲完成
2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是()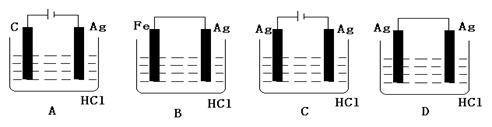
下列叙述正确的是()
| A.电解法精炼铜时,电解质溶液中铜离子浓度一定不变 |
| B.甲醇和氧气以及KOH溶液构成的新型燃料电池中,其正极上发生的反应为: CH3OH-6e- +8OH- |
| C.在铁上镀铜时,金属铜作阴极 |
| D.溶液、胶体和悬浊液三种分散系的本质区别是分散质微粒直径的大小 |
.将a g无水Na2CO3溶于t℃的饱和Na2CO3溶液中,析出b g晶体,则(b-a) g表示的含义是()
| A.减少的饱和溶液的质量 | B.饱和溶液失去溶质Na2CO3的质量 |
| C.析出Na2CO3·10H2O的质量 | D.饱和溶液失去水的质量 |