将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
| A.两烧杯中铜片表面均无气泡产生 | B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的酸性均减弱 | D.产生气泡的速率甲比乙慢 |
在一定温度下的恒容密闭容器中,当下列物理量不再发生变化时,表明反应
A(s)+3B(g) 2C(g)+D(g)已达平衡状态的是
2C(g)+D(g)已达平衡状态的是
①混合气体的压强;②混合气体的密度;③B的物质的量浓度;④气体的总物质的量;⑤混合气体的平均相对分子质量
| A.①②③ | B.②③⑤ | C.①③⑤ | D.①④⑤ |
一定条件下,对于可逆反应X(g)+3Y(g)  2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
| A.c1∶c2=3∶1 |
| B.平衡时,Y和Z的生成速率之比为2∶3 |
| C.X、Y的转化率不相等 |
| D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1 |
已知:(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1
(2)C(s)+O2(g)=CO2(g) △H2 (3)2H2(g)+O2(g)=2H2O(l) △H3
(4)2CO2(g)+4H2(g)=CH3COOH(l)+2H2O(l) △H4
(5)2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H5
下列关于上述反应的焓变的判断正确的是
| A.△H1>0,△H2<0 | B.△H5=2△H2+△H3-△H1 |
| C.△H3>0,△H5<0 | D.△H4=△H1-2△H3 |
已知键能N≡N 946 kJ/mol ,H-H 436kJ/mol ,N-H 391 kJ/mol.从理论上计算2NH3(g)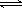 N2(g)+3H2(g)的⊿H为
N2(g)+3H2(g)的⊿H为
| A.-46 kJ/mol | B.-92 kJ/mol |
| C.+92 kJ/mol | D.+1800kJ/mol |
用CH4催化还原NOx可以消除氮氧化合物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
下列说法中错误的是
| A.等物质的量的CH4在反应①、②中转移电子数相同 |
| B.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H>-574kJ/mol |
| C.4NO2(g)+2N2(g)=8NO(g) △H=+586kJ/mol |
| D.若用标准状况下4.48L CH4把NO2还原为N2,整个过程中转移的电子总数为1.6NA |