焦硫酸(H2SO4•SO3)溶于水,其中SO3都转化为硫酸。若将445 g焦硫酸溶于水配成4.00 L硫酸,该硫酸的物质的量浓度为_______________mol/L。
Q、W、X、Y、Z五种短周期元素,原子序数依次增大。Q在元素周期表中原子半径最小,W元素最高正价与最低负价代数和为0;Y与Q同主族;X、Z分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)X、Z简单离子半径较大是(用离子符号表示)。
(2)由这五种元素中的若干种组成的化合物甲、乙、丙、丁在水溶液中有如下转化关系: ,其中丙是溶于水显酸性的气体,丁是强碱。
,其中丙是溶于水显酸性的气体,丁是强碱。
①若乙常作为焙制糕点的发酵粉,则乙含有的化学键类型有;乙溶液中阳离子浓度之和阴离子浓度之和(填“>”、“=”或“<”)。
②若乙是难溶物,甲溶液与过量的丙生成乙的离子方程式为:。
某兴趣小组为探究沉淀溶解平衡的原理并测定某温度下PbI2溶度积常数,设计如下实验。
Ⅰ 取100mL蒸馏水,加入过量的PbI2固体(黄色),搅拌,静置,过滤到洁净的烧杯中,得到滤液。
(1)搅拌的目的是。
(2)取少量滤液于试管中,向其中滴加几滴0.1 mol·L-1KI溶液,观察到的现象是,溶液中c(Pb2+)(填“增大”、“减小”或“不变”)。
Ⅱ 准确量取10.00mL滤液,与离子交换树脂(RH)发生反应:2RH + Pb2+= R2Pb + 2H+,交换完成后,流出溶液用中和滴定法测得n(H+)=3.000×10-5 mol。
(3)在此实验温度下,PbI2的溶度积常数Ksp=。
(4)若步骤Ⅰ盛装滤液的烧杯中有少量水,Ksp测定结果将会(填“偏大”、“偏小”或“无影响”)。
某化学兴趣小组用以下装置探究SO2的某些化学性质。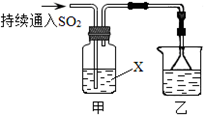
(1)装置乙的作用是。
(2)若X为品红溶液,观察到溶液褪色,说明SO2具有(填序号,下同);若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有。
a.氧化性 b.还原性 c.漂白性
(3)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式: Ca2++
Ca2++ ClO-+
ClO-+ SO2+
SO2+ H2O=
H2O= ↓+
↓+ Cl-+
Cl-+ SO42-+
SO42-+ 。
。
贝沙罗汀(I)是一种新型的合成维甲酸类似物,可用于治疗顽固性皮肤T-细胞淋巴瘤。可由下列为路线合成:
请完成下列问题:
(1)A的化学名称是,E和F反应生成G,已知同时还生成HCl,则F的结构简式为。
(2)①的反应类型是,②的反应类型是。
(3)B与乙二醇可发生缩聚反应生成涤纶,反应的化学方程式是
。
(4)有机物M是A的同分异构体,其结构满足以下条件,写出其结构简式:
(已知:一个碳原子上接两个碳碳双键不稳定)。
①无支链②有四个碳碳双键,无甲基
(5)下列有关贝沙罗汀(I)的说法正确的是。
a.能使酸性KMnO4溶液褪色 b.能发生消去反应
c.1molI能与7molH2反应 d.含有酯基
火电厂排放气体中含有二氧化硫、氮氧化物等大气污染物,大气污染物的研究治理对改善环境具有重要意义。
(1)煤燃烧产生的烟气(含有氮氧化物、SO2、PM2.5等),直接排放到空气中,引发的主要环境问题有。(填写字母编号)
| A.水体富营养化 | B.重金属污染 | C.雾霾 | D.酸雨 |
(2)将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。写出亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式:
。
(3)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下:A的化学式为,若生成ag A,理论上可以回收SO2的质量为g。
(4)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式_。
(5)工业上常用Na2CO3溶液处理煤燃烧产生的烟气,写出SO2、NO与Na2CO3溶液反应生成Na2SO4、N2的离子方程式。