甲、乙两种物质的溶解度曲线如下图所示,根据图示回答下列问题:

(1)甲、乙两种物质中溶解度受温度影响不大的是物质;
(2)
点的意义是。
(3)
℃时,
甲物质加入到
水中充分溶解,形成溶液的质量等于
。
分析、归纳、推理是学习化学的重要方法,请同学们根据下面微观粒子反应(在水式溶液中进行反应,水分子已省略)示意图,分析解决下列问题。
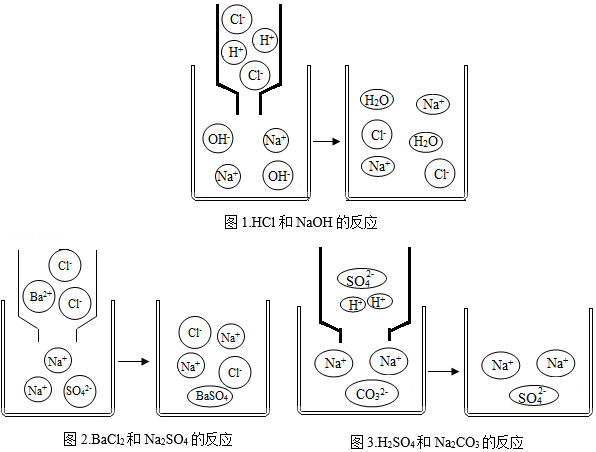
(1)请根据图1、图2、图3任写一个反应的化学方程式 。该反应属于 反应(填基本反应类型);
(2)任选一个反应从微观角度分析该反应的实质 。
(3)请你认真分析图1、图2、图3,从微观角度说明该反应类型发生反应的实质 。
元素周期表是学习化学的重要工具。如图是元素周期表中的一部分,请回答下列问题:
|
第一周期 |
1 H |
2 He |
||||||
|
第二周期 |
3 Li |
4 Be |
5 B |
6 C |
① |
8 O |
9 F |
10 Ne |
|
第三周期 |
11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
(1)表中,①所示元素的名称是 ,相对分子质量最小的氧化物的化学式 。
(2)X2﹣与Ar的核外电子排布相同,则X的元素符号是 ,它处在元素周期表中第 周期;
(3)元素周期表中同族和同周期元素具有一定的相似性和变化规律,同族元素化学性质相似的原因是 相同。
化学在保证人类生存并不断提高生活质量方面起着重要作用。
(1)利用化学生产化肥和农药,以增加粮食的产量,下列肥料属于复合肥的是
A.KNO3 B.CO(NH2)2 C.K2SO4 D.Ca3(PO4)2
(2)钛合金与人体具有很好的“相容性”,可以用来制造人造骨。钛合金属于 (填“纯净物”或“混合物”)
(3)家庭里常常使用活性炭净水器来净化水,利用了活性炭的 性。
化学与人类生产、生活息息相关,现有以下物质(请选择合适物质的序号填空):
①稀硫酸 ②甲烷③小苏打 ④熟石灰
(1)工业上通常用来除铁锈的是 ;
(2)生活中常用作焙制糕点的发酵粉的主要成分是 ;
(3)可以用来做建筑材料的是 ;
(4)天然气的主要成分是 。
2017年10月18日,中国共产党第十九次全国代表大会在北京人民大会堂隆重召开。十九大报告强调,必须树立和践行绿水青山就是金山银山的理念,坚持节约资源和保护环境的基本国策。为了人类和社会经济的可持续发展,我们必须爱护水资源。某校化学兴趣小组的同学对学校附近的水质状况进行了相关调查研究。
(1)该小组取回的水样有些浑浊。用如图所示的自制简易净水器进行了处理。其中小卵石和石英砂起 作用(填操作名称),能除去水中的不溶性杂质。利用活性炭的 性。可除去水质的色素和异味。
(2)可用 检验净化后的水样是硬水还是软水,日常生活中将硬水转化为软水的方法是 。
(3)爱护水资源,一方面要节约用水,另一方面要防止水体污染,请你写出一条节约用水的方法: ;提一条防止水体污染的合理化建议 。
