根据所学的化学知识解答:
(1)用 可以鉴别家庭用水是否硬水,生活中常用 的方法降低水的硬度。
(2)某物质燃烧的微观过程如下:
若“ ”表示碳原子,“
”表示碳原子,“ ”表示氢原子,“
”表示氢原子,“ ”表示氧原子,该生成物A为 (填化学式)。
”表示氧原子,该生成物A为 (填化学式)。
(3)地壳中含量最高的金属元素是 。
(4)炒菜时油锅着火可用锅盖盖灭,其灭火原理是 。
食醋是一种能增强食品酸味的常用调味剂,其主要成分为醋酸(CH3COOH),它与我们的生活密切相关。请你根据所学知识,回答下列问题:
(1)食醋有酸味,因为醋酸的水溶液显____.(填“酸性“、“中性”或“碱性”)。
(2)醋酸中,质量分数最大的元素是____元素。
(3)生活中,可用食醋软化鱼骨和鸡蛋壳,因为醋酸能与它们的主要成分反应,生成醋酸钙、二氧化碳和水。由此可推知鱼骨、鸡蛋壳主要成分是(填化学式)____ ____。
请按要求从氮气、铜、氧化钙、氢氧化钙、氢氧化铁、氯化钠、盐酸中选择合适的物质,将其化学式填写在下列横线上:
(1)空气中的一种单质(2)一种可溶性的盐;
(3)可作干燥剂的氧化物; (4)一种难溶性的碱
实验室现有氯酸钾、二氧化锰、石灰石和稀盐酸,以及下列仪器:
(1)写出图中仪器5的名称 _________ ;
(2)利用上述仪器和药品可以制取和收集二氧化碳,你选择的仪器是 _________ (填序号)发生反应的化学方程式为 _________ ,
(3)若补充一种仪器 _________ ,再利用上述装置和药品还可以制取和收集氧气,你选择的仪器是 _________ (填序号),反应的化学方程式是 _________ .
金属材料在生产生活中十分广泛
(1)根据下图金属应用实例推断,金属具有的物理性质有 _________ (答两点)
(2)生铁和钢都是铁的合金,二者性能不同的原因是 _________ ;
(3)写出工业上以赤铁矿为原料炼铁过程中,一氧化碳与氧化铁发生反应的化学方程式 _________ ;
每年因腐蚀而消费掉的金属材料数量惊人,铁生锈的条件是 _________ ;防止金属腐蚀是保护金属资源的一条有效途径,保护金属资源的途径还有 _________ (答一条即可);
(4)将一定量的锌粉放入稀硫酸、硫酸亚铁、硫酸铜的混合溶液中,充分反应后过滤,向滤渣中加盐酸有气泡产生.则滤渣中一定含有固体的化学式是 _________ ;滤液中一定不含的物质名称是 _________ .
水和溶液在生产生活中重要的作用.
(1)自来水厂常用的净水方法有沉淀、 _________ 吸附、消毒等;在日常生活中常用来降低水的硬度的方法是 _________ ;水是一种宝贵的自然资源,我们必须爱护水资源.预防水污染的措施有 _________ (写一条即可).
(2)如图是甲、乙两种物质的溶解度曲线,回答下列问题: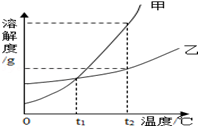
① _________ 时,甲、乙两种物质的溶解度相等;
②若固体甲中含有少量乙时可用 _________ 方法提纯甲(填”蒸发结晶“或”冷却结晶“);
③t2℃用等质量的甲、乙两种物质配置甲、乙的饱和溶液需要水的质量甲 _________ 乙(填“>”“<”或“=”);
④配置一定溶质质量分数的甲物质溶液,以下操作中会导致所配置溶液溶质质量分数偏低的是 _________ .
A、量筒量取水时仰视读数
B、配合的溶液向细口瓶转移时溅出
C、固体甲中含有杂质.