某化学实验小组在实验室中对一杯浑浊的河水进行了简单净化。
(1)先向烧杯加入适量明矾粉末,这是利用明矾溶于水后生成胶状物对杂质的 作用,使悬浮于中水中杂质沉降来达到净水目的。
(2)进行过滤液体,过滤操作所必需玻璃仪器:
| A.烧杯 |
| B.酒精灯 |
| C.铁架台(带铁圈) |
| D.试管 |
E、玻璃棒
F、漏斗
(3)用木炭除去水中的异味;这是利用了木炭具有 的结构。
(4)蒸馏:所得蒸馏水是 (填“硬水”或“软水”)
某化工厂排出的废水透明、澄清、略显蓝色。某同学取少量废水,加入过量的盐酸,有不溶于稀硝酸的白色沉淀生成。过滤,所得的滤液分成两份,一份滤液中加入稀硫酸,也有不溶于稀硝酸的白色沉淀生成;另一份滤液中加入氢氧化钠溶液,产生蓝色沉淀。试回答:
(1)废水中一定含有的物质_______(填编号)。
A.氯化物 B.硫酸盐 C.硝酸盐 D.碳酸盐
(2)该同学查阅有关资料后,设计了一个从废水中除去重金属离子的实验方案: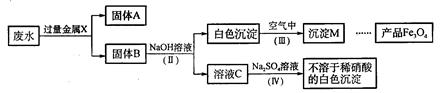
①固体A中一定含有的物质为(写化学式)_______。
②B溶液中的溶质一定含有_______(填序号字母)。
A.Na2CO3 B.Fe(NO3)2 C.MgCl2 D.Ba(NO3)2
③Ⅲ通空气时的化学方程式是4Fe(OH)2+2H2O+O2=4Fe(OH)3,由沉淀M获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O,在第Ⅲ步中应控制“一定量空气”的目的是_______。
④第Ⅳ步反应的化学方程式为_______。
请根据下列装置回答有关问题:
(1)写出图中标有①、②的仪器名称:①为;②为。
(2)若用上述装置制取二氧化碳,则A中发生反应的化学方程式为。要制取和收集一瓶干燥的二氧化碳气体,选用的装置有(填字母代号),其装置接口的连接顺序是(用接口字母顺序从左至右连接)。
(3)利用上述气体发生装置制取氧气,则A中发生反应的化学方程式为。现要配制100g溶质质量分数为6%的双氧水溶液,需要30%的双氧水溶液g,需要加入水的体积为mL。
利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如下(反应条件己略去):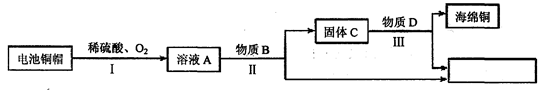
已知:2Cu+2H2SO4+O2 2CuSO4+2H2O
2CuSO4+2H2O
请回答下列问题
(1)过程II中分离操作的名称是,在操作过程中使用到的玻璃仪器有烧杯、
和。
(2)溶液A中的溶质有(填化学式)。
(3)过程III中有气体产生,反应的化学方程式为_______。
(4)A~E中含铜、锌两种元素的物质有(填字母序号)。.
人类的生活和生产都离不开各种材料。
(1)地壳中含量最多的金属元素是(填化学式):炒菜时铁锅中的油着火可用锅盖盖灭,其原理是。
(2)下列物质所选用的材料中,属于有机合成材料的是。
| A.聚乙烯塑料袋 | B.不锈钢刀 | C.陶瓷 | D.铝合金门窗 |
(3)①成语“百炼成钢”是指灼热的生铁经反复捶打转变为钢的过程,其中反应的化学方程式为。
②高炉是工业炼铁的主要设备。写出高炉内铁矿石(主要成分为Fe3O4)生成铁的化学方程式。
写出下列反应的化学方程式并填空。
(1)铜片伸入硝酸银溶液中:,该反应属反应(填基本反应类型)。
(2)碳酸氢铵常温下易分解:;
(3)实验室加热高锰酸钾制氧气:;完全反应后,固体混合物中氧元素的质量和原来相比(填“增大”、“减小”或“不变)。