下列各组元素性质的递变情况错误的是
| A.N、O、F原子半径依次减小 |
| B.P、S、Cl元素最高正价依次升高 |
| C.Li、Be、B原子最外层电子数依次增多 |
| D.Na、K、Rb的电子层逐渐减少 |
铝、破(Be)在元素周期表中的位置是对角线关系,具有相似的化学性质,下列说法正确的是
| A.BeCl2水溶液导电性很强,故BeCl2是离子化合物 |
| B.Na2BeO2溶液PH>7,将其蒸干灼烧后得到固体BeO |
| C.向Na2BeO2溶液中加入过量盐酸制备Be(OH)2 |
| D.Be(OH)2与NaOH反应的离子方程式为:Be(OH)2+2OH-=BeO22-+2H2O |
有关Na2CO3与NaHCO3的性质,以下叙述正确的是
| A.将石灰水加入NaHCO3溶液中不产生沉淀,加入Na2CO3溶液中产生白色沉淀 |
| B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3物质的量之比为1:2 |
| C.等质量的NaHCO3和Na2CO3分别与足量的盐酸反应,在同温同压下,生成CO2的体积相同 |
| D.向Na2CO3饱和溶液中通入CO2有NaHCO3晶体析出 |
设NA为阿伏加德罗常数数值,下列说法正解的是
| A.1molFe2+与足量的H2O2溶液反应,转移2NA个电子 |
| B.50ml18.4mol·L-1浓H2SO4与足量铜微热反应,生成SO2分子的数目为0.46NA |
| C.将含3NA个离子的Na2O2固体溶于水配成1L溶液,所得溶液中Na+的浓度为2mol·L-1 |
| D.标况状态下,22.4L氨水含有NA个NH3分子 |
下列物质转化在给定的条件能实现的是
A.MgO MgCl2(ag) MgCl2(ag) 无水MgCl2 无水MgCl2 |
B.Al2O3 NaAlO2(ag) NaAlO2(ag) AlCl3 AlCl3 |
C.Fe FeCl2 FeCl2 FeCl3 FeCl3 |
D.Cu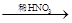 NO2 NO2 NO NO |
下列离子能大量共存,且满足相应条件的是
| 选项 |
离子组 |
条件 |
| A |
K+,Na+,Cu2+,Cl- |
溶液呈无色 |
| B |
Na+,Fe3+,NO3-,SO42- |
滴入酸性KMnO4溶液,溶液褪色 |
| C |
Al3+,SO42-,Cl-,H+ |
加入氨水产生白色沉淀后沉淀溶解 |
| D |
Na+,NO3-,I-,SO42- |
加入盐酸和淀粉溶液变蓝 |