NA为阿伏加德罗常数,下列说法正确的是
| A.标准状况下,11.2L的戊烷所含的分子数为0.5 NA |
| B.26g乙炔所含共用电子对数目为3 NA |
| C.标准状况下,11.2 L CCl4所含分子数为0.5 NA |
| D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA |
有关下图装置的说法中正确的是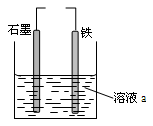
| A.若两电极直接连接,a是食盐水,则发生析氢腐蚀 |
| B.若铁接电源负极,石墨接电源正极,a是稀H2SO4溶液,电解一段时间后溶液的pH增大 |
| C.若两电极直接连接,则电子从铁流向石墨 |
| D.若铁接电源正极,石墨接电源负极,a是氯化铜溶液,阴离子向石墨电极移动 |
对于反应A2(g)+ 3B2(g)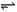 2C(g),以下表示其化学反应速率最快的是
2C(g),以下表示其化学反应速率最快的是
A.v(A2) =0.4mol/(L•s)B.v(B2) =0.8mol/(L•s)
C.v(C) =0.6mol/(L•s)D.v(B2) =4.2mol/(L•min)
下列热化学方程式中ΔH的数值表示可燃物燃烧热的是
| A.N2H4(g)+O2(g)===N2 (g)+ 2H2O(g)ΔH=-534.4 kJ·mol-1 |
| B.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1 |
| C.2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1 |
D.CO(g)+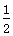 O2(g)===CO2(g)ΔH=-283 kJ·mol-1 O2(g)===CO2(g)ΔH=-283 kJ·mol-1 |
①4Al(s)+3O2(g)===2Al2O3(s)ΔH=-2834.9 kJ·mol-1
②4Al(s)+2O3(g)===2Al2O3(s)ΔH=-3119.1 kJ·mol-1
由此得出的正确结论是
| A.等质量的O2比O3能量高,由O2变为O3为放热反应 |
| B.等质量的O2比O3能量低,由O2变为O3为吸热反应 |
| C.O3比O2稳定,由O2变为O3为吸热反应 |
| D.O2比O3稳定,由O2变为O3为放热反应 |
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是
A.2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1 2SO3(g) ΔH=-196.6 kJ·mol-1 |
B.2SO2(g)+O2(g) 2SO3(g) ΔH=-98.3 kJ·mol-1 2SO3(g) ΔH=-98.3 kJ·mol-1 |
C.SO2(g)+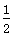 O2(g) O2(g) SO3(g) ΔH=+98.3 kJ·mol-1 SO3(g) ΔH=+98.3 kJ·mol-1 |
D.SO2(g)+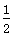 O2(g) O2(g) SO3(g) ΔH=-196.6 kJ·mol-1 SO3(g) ΔH=-196.6 kJ·mol-1 |