已知酸性大小:羧酸>碳酸>酚>HCO3﹣.下列含溴化合物中的溴原子,在适当条件下都能被羟基(﹣OH)取代(均可称之为水解反应),所得产物能跟NaHCO3溶液反应的是
| |
A. |
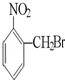 |
B. |
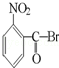 |
C. |
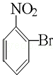 |
D. |
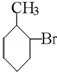 |
下列试剂的保存方法错误的是
| A.少量的钠保存在煤油中 |
| B.浓硝酸保存在无色玻璃瓶中 |
| C.新制的氯水保存在棕色玻璃瓶中 |
| D.氢氧化钠溶液保存在具橡皮塞的玻璃瓶中 |
下列物质属于含有共价键的离子化合物的是
| A.C60 | B.C6H6 | C.KF | D.NaOH |
在水溶液中能大量共存的离子组是
| A.Mg2+、NH4+、HCO23—、OH— |
| B.Na+、AlO2—、CO32—、OH— |
| C.Ca2+、Fe2+、H+、NO3— |
| D.Fe3+、K+、SCN—、SO42— |
下列说法正确的是
A.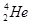 原子核内含有4个质子 原子核内含有4个质子 |
| B.32S与33S是同种核素 |
| C.正丁烷与异丁烷互为同系物 |
D.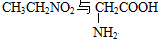 互为同分异构体 互为同分异构体 |
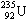 是制造原子弹的材料和核反应堆的燃料。
是制造原子弹的材料和核反应堆的燃料。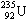 的原子核内的中子数与核外电子数之差是
的原子核内的中子数与核外电子数之差是
| A.235 | B.143 | C.92 | D.51 |