根据下表中烃的分子式排列规律,判断空格中烃的同分异构体数目是
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| CH4 |
C2H4 |
C3H8 |
C4H8 |
|
C6H12 |
C7H16 |
C8H16 |
A.3 B.4 C.5 D.6
生活中处处有化学。下列说法正确的是
| A.油脂、淀粉、纤维素以及蛋白质均可作为人类的营养物质 |
| B.乙烯和氯乙烯都可以通过聚合反应得到高分子材料 |
| C.乙醇、乙酸和甲醛广泛应用于食品加工 |
| D.将氯气通入澄清石灰水中制漂白粉 |
某溶液中可能含有Na+、K+、AlO2-、CO32-、SO32-、Cl-中的若干种离子。某同学设计并完成了如下实验: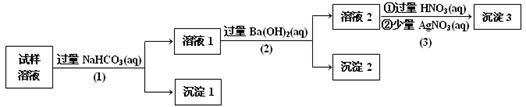
已知:AlO2-+HCO3-+H2O==Al(OH)3+CO32-
根据以上实验操作与现象,该同学得出的结论不正确的是
| A.沉淀2放置在空气中,若质量增加,试样中肯定存在SO32- |
| B.试样溶液中加入稍过量的NH4Cl溶液能得到与沉淀1成分相同的物质 |
| C.上述流程步骤(1)(2)(3)的顺序改为(3)(2)(1),可能会获得相同的实验现象 |
| D.试样溶液中肯定存在AlO2-、Cl-,其中Na+、K+至少存在1种 |
室温时,向20 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生,且混合溶液的体积可看成混合前两溶液的体积之和),下列说法不正确的是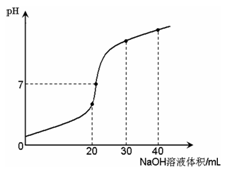
| A.pH=7时,溶液中c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B.当V(NaOH)=20mL时,溶液中水的电离程度比纯水大 |
| C.当V(NaOH)=30mL时,溶液中 c(SO42-)+ c(H+)=c(NH3·H2O) + c(OH-) |
| D.滴加NaOH溶液从30mL至40mL,溶液中Na+与SO42-浓度之和始终为0.1 mol·L-1 |
用酸性氢氧燃料电池电解硫酸钠饱和溶液的装置如图所示(a、b为铜电极)。下列说法中不正确的是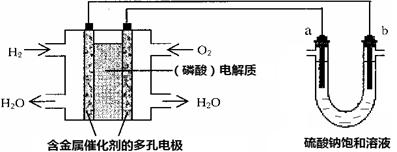
| A.电池工作时,正极反应式为:O2 + 4H++ 4e-= 2H2O |
B.电解时,当阴极逸出a mol气体,同时有W克Na2SO4•10H2O 析出,保持温度不变,剩余溶液中的硫酸钠的质量分数是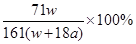 |
| C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D.忽略能量损耗,当电池中消耗0.01g O2 时,b 极周围会产生0.02g H2 |
下列说法或表述中不正确的是
A.视黄醛(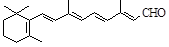 )的分子式为C20H28O )的分子式为C20H28O |
| B.葡萄糖、氨基酸在一定条件下都能发生酯化反应 |
| C.某单官能团有机化合物,只含碳、氢、氧三种元素,相对分子质量为58,完全燃烧时产生等物质的量的CO2和H2O。则它可能的链状结构共有4种(不考虑立体异构) |
| D.醋酸和硬脂酸互为同系物,则C2H6和C9H20也一定互为同系物 |