向紫色Cr2(SO4)3溶液中加入NaOH溶液至析出蓝灰色沉淀,此时,溶液中存在着如下平衡:Cr3+(紫色)+ 3OH- Cr(OH)3(灰蓝色)
Cr(OH)3(灰蓝色) CrO2-(绿色)+ H+ + H2O。将上述悬浊液等分为两份,向a试管中加入适量的NaOH溶液,向b试管中加入适量的H2SO4溶液。a、b试管中溶液颜色最终分别为
CrO2-(绿色)+ H+ + H2O。将上述悬浊液等分为两份,向a试管中加入适量的NaOH溶液,向b试管中加入适量的H2SO4溶液。a、b试管中溶液颜色最终分别为
| 选项 |
A |
B |
C |
D |
| a试管 |
紫色 |
蓝灰色 |
绿色 |
蓝灰色 |
| b试管 |
绿色 |
绿色 |
紫色 |
紫色 |
下列说法中不正确的是( )
| A.在共价化合物中也可能含有离子键 |
| B.非金属元素形成的化合物一定是共价化合物 |
| C.含有共价键的化合物不一定是共价化合物 |
| D.含有离子键的化合物一定是离子化合物 |
下图是氯化钠晶体结构示意图,其中与每个Na+距离最近且相等的Cl-所围成的空间几何构型为( )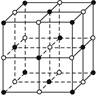
| A.正四面体 | B.正六面体 |
| C.正八面体 | D.正十二面体 |
下列原子序数值代表的元素,既能形成离子键,又可形成金属键的是( )
| A.17 | B.12 | C.19 | D.10 |
下列物质中,既含有离子键,又含有共价键的是( )
| A.H2O | B.CaCl2 | C.NaOH | D.Cl2 |
XY2是离子化合物,X和Y离子的电子层结构都与氖原子相同,则X、Y为( )
| A.Ca和Cl | B.K和S | C.Ca和F | D.Mg和F |