在容积为10 L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g) + H2O CO2(g) + H2(g) ΔH < 0。CO和H2O浓度变化如图所示。
CO2(g) + H2(g) ΔH < 0。CO和H2O浓度变化如图所示。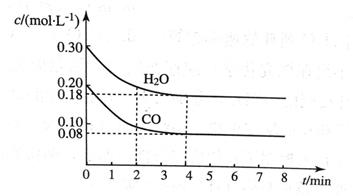
(1)则0~4 min内反应速率v(CO)为__________mol/(L·min);
(2)1000℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。
1000℃时物质浓度的变化
| t/min |
c(CO)/(mol·L-1) |
c(H2O)/(mol·L-1) |
c(CO2)/(mol·L-1) |
c(H2)/(mol·L-1) |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 1 |
0.138 |
0.238 |
0.062 |
0.062 |
| 2 |
c1 |
c2 |
c3 |
c3 |
| 4 |
c1 |
c2 |
c3 |
c3 |
| 5 |
0.116 |
0.216 |
0.084 |
0.084 |
| 6 |
0.096 |
0.266 |
0.104 |
0.104 |
①c1数值_____0.08 mol/L(填“<” “>” 或“=”);
②表中5~6 min之间数值发生变化,可能的原因是_______(填字母)。
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
如图是稀盐酸和氢氧化钠溶液反应过程中溶液酸碱度的变化情况。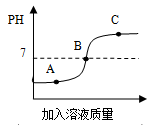
(1)该实验操作是将 滴加到另一种溶液中。
(2)A点时溶液中的溶质是 (填化学式)。
(3)右下图是反应中某时的微观图示,此时对应于上图中A、B、C中的哪一点? ;证明你的判断正确的实验操作方法是:向反应后的溶液中滴加 溶液。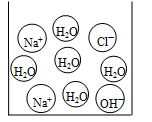
如下左图是甲、乙两种物质的溶解度曲线,右图所示两个烧杯中各盛有20℃时两种物质的饱和溶液。请你通过分析,回答下列问题:

(1)下列方法中能使甲物质的溶解度增大的是
| A.溶解时搅拌 | B.升高温度 | C.降低温度 | D.增加水的质量 |
(2)在80℃时,将55克甲物质放到50克水中,形成溶液的质量是 克。
(3)不改变溶质质量分数使接近饱和的乙的不饱和溶液变为饱和溶液的方法是 。
(4)当温度由20℃升高到60℃时(不考虑水分蒸发),B烧杯中固体质量增多,则B烧杯溶液中的溶质是 (填“甲”或“乙”)。
(5)将80℃的甲、乙饱和溶液降温到40℃,得到的溶液中溶质的质量分数大小关系是甲 乙(填“>”、“=”或“<”)。
(6)甲中含有少量乙时,提纯甲的方法是 。
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤: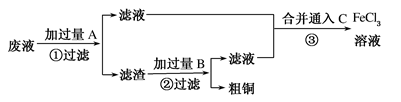
(1)写出FeCl3溶液与Cu反应的离子方程式___________,若Fe和Cu及稀硫酸构成原电池,_______可做负极材料。可通过向滤液中加入________(填化学式)溶液来检验Fe3+的存在,现象是__________。
(2)写出上图步骤③相关反应的化学方程式:③____________。C还可以用______(填化学式),用这种物质反应后不引入新的杂质。
(3)请写出焊接钢轨时发生反应的化学方程式 。
(本题共15分)在实验室可以在试管A中加入3 mL 乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸和2 mL 乙酸,按下图所示(挟持和加热仪器略去)连接好装置进行实验,以制取乙酸乙酯。回答下列问题:
(1)浓硫酸的主要作用是①________,②________。
(2)试管B中盛放的溶液是________,B中通蒸气的导管不能插入溶液中目的是_______。
(3)做此实验时,有时还向A试管里加入几块碎瓷片,其目的是________。
(4)制取乙酸乙酯的反应方程式是_____________,反应类型_ 。
(5)长的玻璃导管的作用是_ 。
(6)实验完成后,观察到试管B的液面上有透明的不溶于水的油状液体产生。可通过________(填操作名称)的方法进行分离。
(7)若要分离沸点不同且互溶的液体,该操作名称________。
(8)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是_______________,反应类型是_________,请写出由乙醇制取乙烯的化学方程式 。
t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)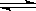 2SO3(g),△H=-Q,10分钟时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白
2SO3(g),△H=-Q,10分钟时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白
(1)从反应开始到达化学平衡,生成SO3的平均反应速为 ;平衡时SO2转化率为 。
(2)下列叙述能证明该反应已达到化学平衡状态的是 (填标号,下同)。
A.溶器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时生成nmolO2
E.相同时间内消耗2nmolSO2的同时消耗nmolO2
(3)反应达到化学平衡后,以下操作将引起平衡向正反方向移动并能提高SO2转化率的是________。
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.降低温度
D.使用催化剂
E.向容器中通入少量氦气(已知:氦气和SO2、O2、SO3都不发生反应)
(4)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为________。