反应:2SO2+O2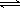 2SO3,经过一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·s),则这段时间为
2SO3,经过一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·s),则这段时间为
| A.0.1s | B.2.5s | C.5s | D.10s |
下列叙述正确的是
| A.可以根据PbI2和AgCl的Ksp的大小比较两者的溶解度 |
| B.常温下,同浓度的Na2S与NaHS溶液相比,NaHS溶液的pH大 |
| C.等物质的量浓度的CH3COONH4溶液和NH4HSO4溶液,前者的c(NH4+)大 |
| D.用惰性电极电解饱和NaCl溶液,若有1.0 mol电子转移,则理论生成1.0 mol NaOH |
常温下,下列各溶液的叙述中正确的是

A.0.10 mol·L-1的醋酸钠溶液20mL与0.10 mol·L-1盐酸10mL混合后溶液显酸性: c (CH3COO-)>c (Cl-)>c (H+)>c (CH3COOH) c (CH3COO-)>c (Cl-)>c (H+)>c (CH3COOH) |
B.pH=7的醋酸钠和醋酸混合液中:c(Na+)= c(CH3COO-)=" c" (H+)=c(OH-) |
C.若0.10 mol·L-1的醋酸的pH=a,0.010 mol·L-1的醋酸的pH=b,则a+1>b |
D.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中: |
 [c(Na+)-c(F-)]< [c(K+)-c(CH3COO-)]
[c(Na+)-c(F-)]< [c(K+)-c(CH3COO-)]
爱迪生蓄电池在充电和放电时发生的反应:Fe+ NiO2+2H2O Fe(OH)2+Ni(OH)2,
Fe(OH)2+Ni(OH)2,
下列该蓄电池推断错误的是:
①放电时,Fe参与负极反应,NiO2参与正极反应
②充电时,阴极上的电极反应式为:Fe(OH)2 + 2e-=" Fe" + 2OH-
③放电时,电解质溶液中的阴离子向正极方向移动
④放电时,负极上的电极反应式为:Fe + 2H2O-2e- = Fe(OH)2 + 2H+
⑤蓄电池的电极必须浸入某种碱性电解质溶液中
| A.只有③ | B.③④ | C.④⑤ | D.①②⑤ |
关于下列四个图像的说法中正确的是
A.图①表示可逆反应“CO(g) + H2O(g) CO2(g)+H2(g)”中的ΔH小于0 CO2(g)+H2(g)”中的ΔH小于0 |
| B.图②是在长时间电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1︰1 |
C.图③表示可逆反应“A2(g)+3B2(g) 2AB3(g)”的ΔH大于0 2AB3(g)”的ΔH大于0 |
D.图④表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极)。下列说法中正确的是()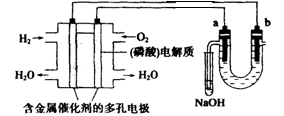
| A.电池工作时,正极反应式为:O2+2H2O+4e- ="==" 4OH- |
| B.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| C.电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者 |
| D.当电池中消耗0.02gH2时,a极周围会产生0.02gH2 |