下图分别表示四种操作,其中有两个错误的是( )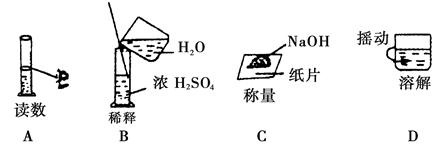
下列物质的提纯方法可能属于化学变化的是( )
| A.蒸馏 | B.过滤 | C.分液 | D.洗气 |
2010年的冬天,我国的天气呈现反常现象,南方持续降雪,西北部遭受大雪袭击。下雪时,常用融雪剂清理路面,醋酸钾(CH3COOK)是效果较好的融雪剂,下列关于1mol CH3COOK的叙述正确的是( )
| A.1mol CH3COOK含有3×6.02×1023个H |
| B.摩尔是国际单位制中七个基本物理量之一 |
| C.1mol CH3COOK含有2mol氧 |
| D.CH3COOK的摩尔质量为98g |
下列有关化学方程式或离子方程式书写错误的是()
| A.将分别蘸有浓盐酸和浓氨水的玻璃棒靠近:NH3+HCl=NH4Cl |
| B.在酸性溶液中S2-和SO32-不能共存:2S2-+SO32-+6H+=3S↓+3H2O |
| C.不能用排空气法收集NO气体的原因:2NO+O2=2NO2 |
| D.泡沫灭火器的工作原理:3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑ |
下列说法中正确的是( )
| A.KOH的摩尔质量是56 g |
| B.一个碳原子的质量就是其相对原子质量 |
| C.硫原子的质量就是硫的相对原子质量 |
| D.氦气的摩尔质量(单位:g·mol-1)在数值上等于它的相对原子质量 |