碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn+2MnO2+H2O==Zn(OH)2+Mn2O3。下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2+H2O+2e— ="=" Mn2O3+2OH— |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
从1 L 1 mol/LNaOH溶液中取出100 mL,下列关于这100 mL溶液的叙述中错误的是
| A.含NaOH 0.1 mol | B.浓度为 1 mol/L |
| C.含NaOH 4g | D.浓度为0.1 mol/L |
相同物质的量的H2SO4与H3PO4中的氢原子数之比为
| A.2: 3 | B.3: 2 | C.1:2 | D.2:1 |
据某权威刊物报道,科学家在宇宙中发现了H3分子,对于相同物质的量的H3和H2,下列各项中一定相等的是
| A.原子数 | B.分子数 | C.体积 | D.质量 |
下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是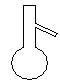
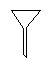
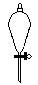
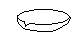
| A.蒸馏、蒸发、萃取、过滤 | B.蒸馏、过滤、萃取、蒸发 |
| C.萃取、过滤、蒸馏、蒸发 | D.过滤、蒸发、萃取、蒸馏 |
如果你在厨房不小心将花生油与凉开水混在一起,你将采用下列何种方法进行分离
| A.过滤 | B.蒸馏 | C.分液 | D.萃取 |