下表中实验操作能达到实验目的的是
| |
实验操作 |
实验目的 |
| A |
向苯酚溶液中滴加稀溴水 |
观察白色沉淀三溴苯酚 |
| B |
向待测液中加入碳酸钠溶液 |
鉴别乙酸、乙酸乙酯、乙醇 |
| C |
向3ml5%CuSO4溶液中滴加3-4滴2%氢氧化钠溶液,再向其中加入0.5ml乙醛,加热 |
检验醛基 |
| D |
将溴乙烷与氢氧化钠溶液共热,冷却,继续滴加硝酸银溶液 |
检验溴乙烷中的溴元素 |
有关下图的说法正确的是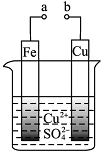
| A.构成原电池时溶液中SO42-移向Cu极 |
| B.构成原电池时Cu极反应为: Cu﹣2e-===Cu2+ |
| C.构成电解池时Fe极质量既可增也可减 |
| D.a和b分别接直流电源正、负极,Fe极会产生气体 |
为了配制NH4+的浓度与Cl―的浓度比为1:1的溶液,可在NH4Cl溶液中加入
①适量NH4NO3 ;②适量NaCl;③适量氨水;④适量NaOH
| A.①② | B.①③ | C.②③ | D.②④ |
下列实验操作或所记录的数据合理的是
| A.NaOH溶液可保存在玻璃塞的试剂瓶中 |
| B.一学生用pH试纸测得某氯水的pH为2 |
| C.液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 |
| D.配制硫酸亚铁溶液,是将绿矾晶体溶于蒸馏水再加入一定量的铁粉 |
对于常温下pH=12的氨水,下列说法正确的是
| A.由水电离产生的c(OH-)=10-12mol·L-1 |
| B.向溶液中加入等体积的pH=2盐酸后溶液呈酸性 |
| C.向溶液中加入稀盐酸可以促进氨水的电离,溶液的碱性增强 |
| D.向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) |
下列与处理方法对应的反应方程式正确的是
| A.用热的Na2CO3溶液去除油污:CO32- + H2O ===HCO3- + OH- |
| B.用FeS去除废水中的Hg2+:Hg2+ + S2-===HgS↓ |
C.用催化法处理汽车尾气中的CO和NO:CO + NO C + NO2 C + NO2 |
D.向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3+ + 3H2O Al(OH)3(胶体)+ 3H+ Al(OH)3(胶体)+ 3H+ |