由短周期前10号元素组成的物质T和X,发生如图所示的转化: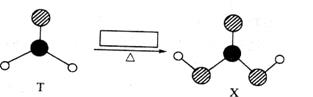
X不稳定,易分解。为使得下列转化能够成功进行,方框内不可能加入的反应试剂是
| A.Ag(NH3)2OH | B.溴水 |
| C.酸性KMnO4溶液 | D.NaOH溶液 |
在1 L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol•L-1和1.5 mol•L-1,现向该溶液中加入39.2 g铁粉使其充分反应。下列有关说法正确的是
| A.反应后溶液中Fe3+物质的量为0.8 mol |
| B.反应后产生13.44 L H2(标准状况) |
| C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol |
| D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 |
下列说法正确的是
A.按系统命名法,化合物 的名称是2,5,5—三甲基—3—乙基庚烷 的名称是2,5,5—三甲基—3—乙基庚烷 |
B.将 与NaOH的醇溶液共热可制备CH3—CH═CH2 与NaOH的醇溶液共热可制备CH3—CH═CH2 |
C.向柠檬醛 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 |
D. 、 、 、 、 三种氨基酸脱水,最多可生成6种二肽。 三种氨基酸脱水,最多可生成6种二肽。 |
下列说法正确的是
A.一定条件反应:2CO(g)  CO2(g)+C(s)可自发进行,则该反应的△H>0 CO2(g)+C(s)可自发进行,则该反应的△H>0 |
| B.向硫酸亚铁溶液中滴加硫氰化钾溶液产生血红色沉淀说明溶液已变质 |
| C.在反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,当生成1.5mol Cl2时,反应中转移的电子数为2.5NA |
| D.相同物质的量浓度的下列溶液:①NH4HSO4②NH4Cl③NH3·H2O,水电离程度由大到小的顺序是:①>②>③ |
已知A、B、C、D之间的转化关系如图所示。下列说法正确的是
A.若A为Fe,D为氢气,则B一定为酸
B.若A、D为化合物,B为水,则C一定是气体单质
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
最近有研究人员发现了一种处理高浓度乙醛废水的新方法—隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法正确的是
| A.若以CH4—空气燃料电池为直流电源,燃料电池的b极应通入空气 |
| B.电解过程中,阴极区Na2SO4的物质的量增大 |
| C.阳极反应CH3CHO -2e- + 2H+="=" CH3COOH + H2O |
| D.电解过程中,两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2 |