溶液、胶体和浊液这三种分散系的根本区别是
| A.是否是大量分子或离子的集合体 | B.是否能通过滤纸 |
| C.分散质粒子直径的大小 | D.是否均一、透明、稳定 |
恒压下,在-个可变容积的密闭容器中发生如下反应:2SO2(g)+ O2(g)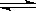 2SO3(g);若开始时放入2mol SO2和1mol O2,达平衡后,生成amol SO3;若开始时放入xmol SO2、2mol O2和2mol SO3,达平衡后,SO3的物质的量是3a mol,则x为
2SO3(g);若开始时放入2mol SO2和1mol O2,达平衡后,生成amol SO3;若开始时放入xmol SO2、2mol O2和2mol SO3,达平衡后,SO3的物质的量是3a mol,则x为
| A.1mol | B.2mol | C.3mol | D.4mol |
氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是 H2+2NiO(OH) 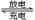 2Ni(OH)2。下列叙述正确的是
2Ni(OH)2。下列叙述正确的是
| A.电池放电时,电池负极周围溶液的pH不断增大 |
| B.电解质溶液可以是稀硫酸 |
| C.外电路中每通过0.2mol电子,H2的质量理论上减小0.2g |
| D.电池工作时,电子由正极通过外电路流向负极 |
室温下,取浓度相同的NaOH溶液和HCl溶液,以体积比3:2相混合,所得溶液的pH=12,则原溶液的浓度为
| A.0.01mol/L | B.0.017mol/L | C.0.05mol/L | D.0.50mol/L |
下列叙述正确的是
| A.当溶液中c(H+)=c(OH-)>10-7 mol/L时,其pH<7,溶液呈现酸性 |
| B.室温下,pH=3的盐酸和pH=11的氨水等体积混合后,溶液中离子浓度关系是: c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| C.Na2CO3溶液中存在c(OH-)= c(HCO3-) +2 c(H2CO3) + c(H+) |
| D.0.1mol/LNaHCO3中c(Na+)= c(HCO3-) + c(H2CO3) = 0.1mol/L |
在平衡体系Ca(OH)2(s) 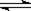 Ca2+(aq)+2OH-(aq)中,能使c(Ca2+)减小,而使pH增大的是
Ca2+(aq)+2OH-(aq)中,能使c(Ca2+)减小,而使pH增大的是
| A.加入少量MgCl2固体 | B.加入少量HCl溶液 |
| C.加入少量KCl固体 | D.加入少量Ba(OH)2固体 |