铅蓄电池用途极广,电解液为30% H2SO4溶液,电池的总反应式可表示为:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
2PbSO4(s)+2H2O(l)
下列有关叙述正确的是
| A.放电时电解液的密度不断增大 |
| B.放电时电子从Pb通过导线转移到PbO2 |
| C.充电时Pb极与外电源的负极相连 |
| D.充电时PbO2电极发生还原反应,Pb电极上发生氧化反应 |
在t℃下,某反应达到平衡,平衡常数K=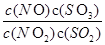 。恒容时,温度升高,NO浓度减小。下列说法正确的是
。恒容时,温度升高,NO浓度减小。下列说法正确的是
| A.升高温度,逆反应速率减小 |
B.该反应化学方程式为:NO+SO3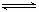 NO2+SO2 NO2+SO2 |
| C.该反应的焓变为正值 |
| D.K表达式中,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度 |
在容积固定的密闭容器中发生反应:Fe(s)+CO2(g)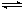 FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。下列说法正确的是
FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。下列说法正确的是
| A.从700 ℃到900 ℃,平衡体系中气体的密度变大 |
B.该反应的化学平衡常数表达式为K=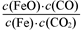 |
| C.绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 |
| D.该反应的正反应是放热反应 |
反应CO2(g)+2NH3(g)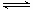 CO(NH2)2(s)+H2 O(g)△H<0,达到平衡时,下列说法正确的是
CO(NH2)2(s)+H2 O(g)△H<0,达到平衡时,下列说法正确的是
| A.加入催化剂,平衡常数不变 |
| B.减小容器体积,正、逆反应速率均减小 |
| C.增大CO(NH2)2的量,CO2的转化率减小 |
| D.降低温度,平衡向逆反应方向移动 |
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
| A.K值不变,平衡可能移动 | B.平衡移动,K值一定变化 |
| C.平衡移动,K值可能不变 | D.K值变化,平衡一定移动 |
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③2.0molPCl3和1.0molCl2充入恒容的密闭容器中,发生反应:PCl3(g)+ Cl2(g) PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,在相同温度下再达平衡时PCl5的物质的量应大于0.20mol而小于0.40mol
PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,在相同温度下再达平衡时PCl5的物质的量应大于0.20mol而小于0.40mol
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡不会发生移动
| A.①④ | B.①②③ | C.②③④ | D.①②③④ |