根据相应的图像(图像编号与答案一一对应),判断下列相关说法正确的是
A.密闭容器中反应达到平衡,T0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂
B.反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b
C.物质的百分含量和温度关系如图所示,则该反应的正反应为放热反应
D.反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体、D为固体或液体
合成氨反应:N2(g)+3H2(g) 2NH3(g)DH=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如图,下列说法正确的是
2NH3(g)DH=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如图,下列说法正确的是
| A.t1时升高了温度 | B.t2时增大了压强 |
| C.t3时减小了NH3的浓度 | D.t4时降低了温度 |
已知热化学方程式:SO2(g)+1/2O2(g) SO3(g)DH=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
SO3(g)DH=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
| A.=196.64kJ | B.=196.64kJ·mol-1 | C.<196.64kJ | D.>196.64kJ |
下列有关原电池叙述正确的是
| A.原电池是将化学能转变成电能的装置。 |
| B.在原电池中失去电子的一极是阴极 |
| C.原电池的两极一定是由活动性不同的两种金属组成 |
| D.原电池的负极发生的是还原反应 |
已知锌及其化合物的性质与铝及其化合物相似。如图,横坐标为溶液的pH,纵坐标为Zn2+离子或[Zn(OH)4]2-离子的物质的量浓度(假设Zn2+离子浓度为10-5mol·L-1时,Zn2+离子已沉淀完全)。下列说法不正确的是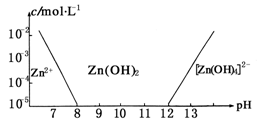
| A.往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为: Zn2++4OH-=[Zn(OH)4]2- |
| B.从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17 |
| C.某废液中含Zn2+离子,沉淀Zn2+离子可以控制溶液pH的范围是8~12 |
| D.向1 L 1 mol·L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH 0.2 mol |
下列关于电解质溶液的判断正确的是
| A.相同物质的量浓度的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4 ④NH3·H2O,c(NH4+) 由大到小的顺序是:①>②>③>④ |
| B.物质的量浓度相等的 H2S 和 NaHS 混合溶液中: c(Na+) +c(H+) = c(S2-) +c(HS-)+c(OH―) |
| C.HF比HCN易电离,则NaF溶液的pH一定比NaCN溶液小 |
| D.常温下pH=6的酸性溶液中,不可能存在NH3·H2O分子 |