根据下图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,判断下列说法正确的是
| A.该反应中反应物所具有的总能量高于生成物所具有的总能量 |
| B.2 mol N原子结合生成N2(g)时需要放出946 kJ能量 |
| C.1 mol NO(g)分子中的化学键断裂时需要放出632 kJ能量 |
| D.该反应的热化学方程式为:N2+O2=2NO △H=+180 kJ/mol . |
下列混合物的分离方法不正确的是
| A.泥沙和食盐(溶解,过滤) | B.汽油和水(分液) |
| C.KNO3和KCl(降温结晶) | D.乙醇和水(分液) |
下列图示实验操作,能达到目的的是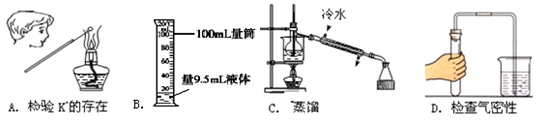
同温同压下,等质量的O2和O3相比较,下列结论正确的是
| A.它们的分子数目之比是1:1 | B.它们的氧原子数目之比为2:3 |
| C.它们的密度之比为2:3 | D.它们的体积之比是1:1 |
与100mL 0.5mol·L—1NaCl溶液中的Cl-的物质的量浓度相同的是
| A.100mL 0.5 mol·L—1MgCl2溶液 | B.100mL 0.5mol·L—1KClO3溶液 |
| C.200mL 0.25 mo l·L—1 KCl溶液 | D.200mL 0.5mol·L—1 HCl溶液 |
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
| A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L |
| B.25oC,1.01×105Pa,64gSO2中含有的原子数为3NA |
| C.在常温常压下,11.2LCl2含有的分子数为0.5NA |
| D.标准状况下,11.2LH2O含有的分子数为0.5NA |