根据下列短周期元素性质的数据判断,下列说法正确的是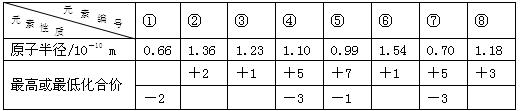
| A.最高价氧化物的水化物酸性:④>⑤ |
| B.与水反应的剧烈程度:②>⑥ |
| C.气态氢化物的稳定性:④> ⑦ |
| D.①⑥⑦形成的化合物是离子化合物 |
下列不能证明氯的非金属性比硫强的实验是
| A.HCl比H2S稳定 |
| B.HCl溶液(盐酸)的酸性比H2S溶液(氢硫酸)的酸性强 |
| C.HClO4溶液的酸性比H2SO4的酸性强 |
| D.氯气比硫有更强的氧化性 |
下列各分子中,所有原子都满足最外层为8电子结构的是
| A.H2O | B.NH3 | C.Cl2 | D.BCl3 |
下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是
| A.液溴和苯分别受热变为气体 | B.干冰和氯化铵分别受热变为气体 |
| C.二氧化硅和铁分别受热熔化 | D.食盐和葡萄糖分别溶解在水中 |
下列离子方程式不正确的是
| A.过量的NaHSO4和Ba(OH)2溶液反应:2H++SO42—+Ba2++2OH—= BaSO4↓+2H2O |
| B.NH4HCO3和过量NaOH溶液相混合:HCO3—+OH—=CO32—+H2O |
| C.NaHSO4溶液中滴加氨水:H++NH3·H2O=NH4++H2O |
| D.向氨水中通入过量的SO2:NH3·H2O+SO2=NH4++HSO3— |
下列说法中错误的是
| A.化学反应中的能量变化通常表现为热量的变化 |
| B.化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
| D.需要加热才能发生的化学反应一定是吸热反应 |