Ⅰ.铁是当代社会中用量最大的金属之一。已知:
①Fe3O4(s)+4C(石墨) 3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
②C(石墨)+CO2(g) 2CO(g) ΔH=+172.5 kJ/mol
2CO(g) ΔH=+172.5 kJ/mol
由Fe3O4(s)与CO反应生成Fe(s)的热化学方程式是 。
Ⅱ.一定条件下,在一容积为4 L的密闭容器中通入0.4 molN2和1.2 molH2,发生反应:N2(g)+3H2(g) 2NH3(g) △H<0;
2NH3(g) △H<0;
(1)当进行到第4分钟时达到平衡,生成NH3为0.4 mol,则从开始到达平衡时NH3的平均速率v(NH3)=_____________。
(2)该条件下,反应的平衡常数表达式K = ______ ,若降低温度,K值将_____(填“增大”“减小”“不变”)
(3)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将___ __移动(“向逆反应方向”、“向正反应方向”或“不”).
(4)在三个相同的容器中各充入1 molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数随时间变化如图。下列说法正确的是 。
a.图Ⅰ可能是不同压强对反应的影响,且P2>P1
b.图Ⅱ可能是不同温度对反应的影响,且T1>T2
c.图Ⅲ可能是同温同压下,催化剂性能,1>2
(5)常压下,把H2和用氦气(He)稀释的N2分别通入一个加热到570℃的电解池装置,H2和N2便可在电极上合成氨,装置中所用的电解质(图中黑细点)能传导H+,则阴极的电极反应式为____________________。
短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子。A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层电子数的3倍,B、C的最外层电子数之和与D的最外层电子数相等。E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏。请回答下列问题:
(1)C的最高价氧化物对应水化物的化学式为,
其中含有的化学键类型为。
(2)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为。
(3)E元素与D元素可形成ED2和ED3两种化合物,下列说法正确的是(填序号)。
①保存ED2溶液时,需向溶液中加入少量E单质
②ED2只能通过置换反应生成,ED3只能通过化合反应生成
③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色
A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大。A和E最外层电子数相同,短周期主族元素的原子中,E原子的半径最大;B、C和F在周期表中相邻,B、C同周期,C、F同主族,F原子的质子数是C原子质子数的2倍;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y);D形成的分子为双原子分子。回答问题:
(1)D元素的名称为,F形成的离子的结构示意图为。
(2)写出液态化合物Y的一种用途。
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式,使用这种气球存在的隐患是。
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应。写出该反应的离子方程式:。
(5)A、B、G三种元素两两组合形成的化合物在空气中相遇形成白烟,反应的化学方程式为。
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。
| 元素 |
信息 |
| B |
其单质在常温下为双原子分子,与A可形成分 子X,X的水溶液呈碱性 |
| D |
其简单阳离子与X具有相同电子数,且是同周 期中简单阳离子中半径最小的 |
| E |
元素原子最外层比次外层少2个电子 |
| C、F |
两种元素的原子最外层共有13个电子 |
则:(1)B的原子结构示意图为。
(2)B、C、E分别与A形成的化合物中最稳定的是(写化学式)。
(3)C与D形成的化合物的化学式是,它的性质决定了它在物质的分类中应属于;请写出该化合物对应水化物电离的方程式。
(4)F的单质在反应中常作剂,该单质的水溶液与E的低价氧化物反应的离子方程式。
现有下列9种微粒: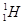 、
、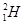 、
、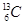 、
、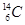 、
、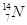 、
、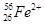 、
、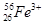 、
、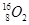 、
、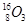 。按要求完成以下各题:
。按要求完成以下各题:
(1) 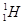 、
、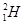 、
、 分别是氢元素的一种,它们互称为。
分别是氢元素的一种,它们互称为。
(2)互为同素异形体的微粒是。
(3)对于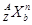 ,按下列要求各举一例(要求:每小题分别写出符合题意的两种粒子,且从以上所给微粒中选择):
,按下列要求各举一例(要求:每小题分别写出符合题意的两种粒子,且从以上所给微粒中选择):
①Z、n、b相同而A不同:;
②A、n、b相同而Z不同:;
③A、Z、b相同而n不同:;
④Z、n、A相同而b不同:。
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。试写出上述反应的化学方程式:
。
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。
①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至后,迅速关闭K1,观察到U形管内的现象是。
②装置Ⅲ中发生反应的化学方程式为。
③蘸NaOH溶液的棉花团的作用是。
④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否含NO。