已知常温下CH3COOH的电离常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示。下列说法不正确的是
| A.c点表示CH3COOH和NaOH恰好完全反应 |
| B.b点表示的溶液中c(CH3COO-)>c(Na+) |
| C.a点表示的溶液中c(CH3COO-)略小于10-3 mol·L-1 |
D.b、d点表示的溶液中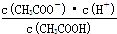 均等于K 均等于K |
已知:H2(g)+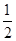 O2(g)=H2O(l)ΔH1=-285.8 kJ·mol-1 ①
O2(g)=H2O(l)ΔH1=-285.8 kJ·mol-1 ①
H2(g)=H2(l) ΔH2=-0.92 kJ·mol-1②O2(g)=O2(l)ΔH3=-6.84 kJ·mol-1③
H2O(g)=H2O(l)ΔH4=-44 kJ·mol-1④
下列说法正确的是
| A.上述四个反应都是吸热反应 |
| B.1 mol液态H2的能量大于1 mol气态H2的能量 |
| C.H2的燃烧热(ΔH)为-285.8 kJ·mol-1 |
D.火箭中液氢燃烧的热化学方程式为H2(l)+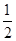 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 |
下列有关物质的性质与应用不相对应的是
| A.二氧化硫具有漂白性,可用于漂白纸浆 | B.常温下,铝能被浓硫酸钝化,可用铝罐贮运浓硫酸 |
| C.MgO熔点很高,可用于制作耐火材料 | D.氢氟酸具有弱酸性,可用于蚀刻玻璃 |
高温下,某反应达平衡,化学平衡常数表达式为: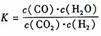 ,恒容时,温度升高H2浓度减小。下列说法正确的是
,恒容时,温度升高H2浓度减小。下列说法正确的是
A.该反应化学方程式为:CO(g)+H2O(g)  CO2(g)+H2(g) CO2(g)+H2(g) |
| B.恒温恒容下,反应达平衡时,再通入一定量的CO2,CO的体积分数一定增大 |
| C.升高温度,正反应速率增大,逆反应速率减小 |
| D.该反应的焓变为正值 |
下列说法不正确的是
| A.Ksp只与难溶电解质的性质和温度有关 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C.其他条件不变,离子浓度改变时,Ksp不变 |
| D.两种难溶电解质作比较时,Ksp小的,溶解度一定小 |
由—CH3、 、—OH、—COOH四种原子团两两组合形成的有机物中,属于弱电解质的有
、—OH、—COOH四种原子团两两组合形成的有机物中,属于弱电解质的有
| A.3种 | B.4种 | C.5种 | D.6种 |